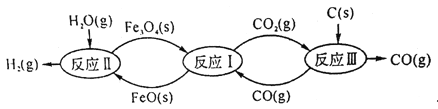
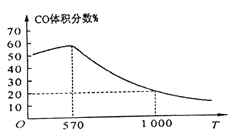
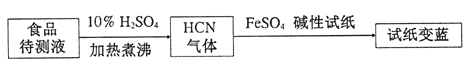
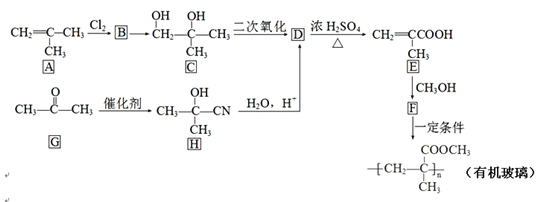
题目内容
【题目】利用所学化学知识解答问题:
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则该反应的热化学方程式应为
(2)已知下列各物质的键能:N≡N 946kJ/mol、H﹣H 436kJ/mol、N﹣H 391kJ/mol,写出合成氨的热化学方程式为
【答案】
(1)CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣725.76 kJ?mol﹣1
O2(g)═CO2(g)+2H2O(l)△H=﹣725.76 kJ?mol﹣1
(2)N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92kJ?mol﹣1
2NH3(g)△H=﹣92kJ?mol﹣1
【解析】解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热为22.68kJ×32=725.76KJ,所以甲醇燃烧的热化学方程式为CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣725.76 kJmol﹣1 ,
O2(g)═CO2(g)+2H2O(l)△H=﹣725.76 kJmol﹣1 ,
所以答案是:CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣725.76 kJmol﹣1;(2)在反应N2+3H22NH3中,断裂3molH﹣H键,1molN三N键共吸收的能量为3×436kJ+946kJ=2254kJ,生成2molNH3 , 共形成6molN﹣H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为2346kJ﹣2254kJ=92kJ,N2与H2反应生成NH3的热化学方程式为,N2(g)+3H2(g)
O2(g)═CO2(g)+2H2O(l)△H=﹣725.76 kJmol﹣1;(2)在反应N2+3H22NH3中,断裂3molH﹣H键,1molN三N键共吸收的能量为3×436kJ+946kJ=2254kJ,生成2molNH3 , 共形成6molN﹣H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为2346kJ﹣2254kJ=92kJ,N2与H2反应生成NH3的热化学方程式为,N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92kJmol﹣1 ,
2NH3(g)△H=﹣92kJmol﹣1 ,
所以答案是:N2(g)+3H2(g) ![]() 2NH3(g)△H=﹣92kJmol﹣1 .
2NH3(g)△H=﹣92kJmol﹣1 .

 阅读快车系列答案
阅读快车系列答案【题目】下表中金属的冶炼原理与方法不完全正确的是( )
选项 | 冶炼原理 | 方法 |
A | 2HgO=2Hg+O2 | 热分解法 |
B | 2Al2O3 (熔融)=4Al+3O2 | 电解法 |
C | Cu2S+O2=2Cu+SO2 | 热分解法 |
D | Fe2O3 +2Al=2Fe+Al2O3 | 热还原法 |
A. AB. BC. CD. D