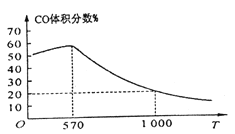
题目内容
【题目】下表是元素周期表的一部分,有关说法正确的是
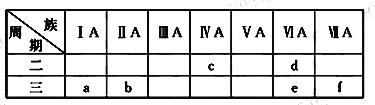
A. e的氢化物比d的氢化物稳定
B. a、b、e三种元素的原子半径:e>b>a
C. c、e、f的最高价氧化物对应的水化物的酸性依次增强
D. 六种元素中,c元素单质的化学性质最活泼
【答案】C
【解析】由元素在周期表中位置,可知a为Na、b为Mg、c为C、d为O、e为S、f为Cl。
A.同主族自上而下非金属性减弱,氢化物稳定性减弱,故d的氢化物比e的氢化物稳定,故A错误;B.同周期自左而右原子半径减小,则原子半径:a>b>e,故B错误;C.c、e、f的最高价氧化物对应的水化物分别为碳酸、硫酸、高氯酸,其中碳酸为弱酸,硫酸为强酸,高氯酸为最强酸,故C正确;D、C为碳元素,原子最外层电子数为4,其余原子最外层电子数大于4或小于4,容易获得或失去电子,与其它元素相比C元素单质化学性质最不活泼,故D错误。故选C。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目