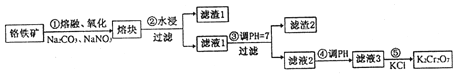
��Ŀ����
����Ŀ��H2��g��+I2��g��2HI��g���Ѿ��ﵽƽ��״̬�ı�־�ǣ� ��
��c��H2��=c��I2��=c��HI��
��c��H2����c��I2����c��HI��=1��1��2
��c��H2����c��I2����c��HI��������ʱ����ı�
�ܵ�λʱ��������nmolH2��ͬʱ����2nmolHI
�ݵ�λʱ��������n mol H2��ͬʱ����n mol I2
��Ӧ����v��H2��=v��I2��= ![]() v��HI��
v��HI��
��һ��H��H�����ѵ�ͬʱ������H��I������
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯
����һ������������ƽ����Է����������ٱ仯��
A.5��
B.4��
C.3��
D.2��
���𰸡�B
���������⣺��ƽ��ʱc��H2����c��I2����c��HI�����߿�����ȣ�Ҳ���ܲ��ȣ�������ʵij�ʼŨ�ȼ�ת�����йأ��ʴ���
��ƽ��ʱŨ��c��H2����c��I2����c��HI������Ϊ1��1��2��Ҳ���ܲ��ȣ�������ʵij�ʼŨ�ȼ�ת�����йأ��ʴ���
��c��H2����c��I2����c��HI��������ʱ����ı䣬˵�����淴Ӧ��ȣ�����ȷ��
�ܵ�λʱ��������nmolH2 �� ��Ч������2nmolHI��ͬʱ����2nmolHI������ȷ��
�ݵ�λʱ��������n mol H2��ͬʱ����n mol I2 �� �������淴Ӧ���ʴ���
��ֻҪ��Ӧ�������ͷ��Ϸ�Ӧ����v��H2��=v��I2��= ![]() v��HI�����ʴ���
v��HI�����ʴ���
��һ��H��H�����ѵ�Ч������H��I���γ�ͬʱ������H��I�����ѣ����淴Ӧ������ȣ�����ȷ��
���¶Ⱥ����һ��ʱ��������ѹǿһֱ���ٱ仯���ʴ���
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯��˵����������Ũ�Ȳ��䣬��Ӧ��ƽ��״̬������ȷ��
���¶Ⱥ�ѹǿһ��ʱ�����������ܶ�һֱ���ٱ仯���ʴ���
����һ������������ƽ����Է�������һֱ���ٱ仯���ʴ���
��ѡB��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���жϵ����֪ʶ������״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�