题目内容
3.甲醇是重要的基础有机化工原料,可由甲烷用铜催化氧化一步法制取或二氧化碳与氢气催化反应及水煤气法间接制备等.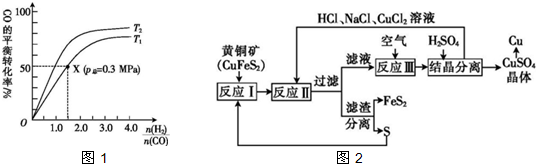
(1)二氧化碳与氢气高温催化反应生成甲醇的化学方程式为CO2+3H2$→_{高温}^{催化剂}$CH3OH+H2O.
(2)已知:CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1;
CO(g)+2H2(g)═CH3OH (g)△H2=-90.1kJ•mol-1;
则反应2CH4(g)+O2(g)═2CH3OH(g)△H=-251kJ•mol-1.
(3)在2L的密闭容器中,起始时均投入2mol CO和一定量H2,发生反应:CO(g)+2H2(g)?CH3OH(g),在不同条件下CO的平衡转化率、与温度的关系如图1所示.
①X点的平衡常数K=4.
②图中T1>(填“>”或“<”)T2.
③为提高CO的转化率,除适当改变反应温度和外,可采取的措施有增大压强、使生成的甲醇液化,从体系中分离出来.
(4)作催化剂的铜可由黄铜矿和硫黄为原料制取,其主要流程如图2:
已知:反应Ⅰ的化学方程式为CuFeS2+S═FeS2+CuS,CuFeS2中S的化合价为-2价.反应Ⅱ滤液的主要成分为CuCl.
①反应Ⅰ中生成12g FeS2转移的电子数为0.1NA.
②反应Ⅱ的离子方程式为CuS+2Cl-+Cu2+═S+2CuCl.
③反应Ⅲ通入空气的目的是将反应Ⅱ生成的一价铜离子氧化成二价铜离子.
分析 (1)二氧化碳与氢气高温催化反应生成甲醇,由原子守恒可知还生成水;
(2)①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1;
②CO(g)+2H2(g)═CH3OH (g)△H2=-90.1kJ•mol-1;
由盖斯定律可知,①×2+②×2可得2CH4(g)+O2(g)═2CH3OH(g),以此计算△H;
(3)①由图可知,CO的转化率为50%,n(H2)/n(CO)=1.5,起始时均投入2mol CO,则投入氢气的3mol,则
CO(g)+2H2(g)?CH3OH(g),
开始 2 3 0
转化 1 2 1
平衡 1 1 1
则CO、H2、CH3OH的平衡浓度分别为0.5、0.5、0.5,以此计算K;
②“先拐先平数值大”知,T1℃先达到平衡状态;
③为提高CO的转化率,可改变条件是平衡正向移动,但不能增加CO的量;
(4)由图可知,I中发生CuFeS2+S═FeS2+CuS,II中发生CuS+2Cl-+Cu2+═S+2CuCl,过滤分离出S、FeS2,滤液中含+1价铜离子,通入空气发生氧化还原还原,以此来解答.
解答 解:(1)二氧化碳与氢气高温催化反应生成甲醇,由原子守恒可知还生成水,反应为CO2+3H2$→_{高温}^{催化剂}$CH3OH+H2O,
故答案为:CO2+3H2$→_{高温}^{催化剂}$CH3OH+H2O;
(2)①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1;
②CO(g)+2H2(g)═CH3OH (g)△H2=-90.1kJ•mol-1;
由盖斯定律可知,①×2+②×2可得2CH4(g)+O2(g)═2CH3OH(g),则△H=(-35.4kJ•mol-1)×2+(-90.1kJ•mol-1)×2=-251kJ•mol-1,
故答案为:-251;
(3)①由图可知,CO的转化率为50%,则
CO(g)+2H2(g)?CH3OH(g),
开始 2 3 0
转化 1 2 1
平衡 1 x-2 1
则CO、H2、CH3OH的平衡浓度分别为0.5、0.5、0.5,
则K=$\frac{0.5}{0.5×(0.5)^{2}}$=4,故答案为:4;
②“先拐先平数值大”知,T1℃先达到平衡状态,则T1>T2,故答案为:>;
③为提高CO的转化率,可改变条件是平衡正向移动,但不能增加CO的量,措施为增大压强或使生成的甲醇液化,从体系中分离出来,故答案为:增大压强;使生成的甲醇液化,从体系中分离出来;
(4)①CuFeS2+S═FeS2+CuS,CuFeS2中S的化合价为-2价,则S元素的化合价由-2价升高为-1价,S元素的化合价由0降低为-1价,该反应中转移e-,即生成1molFeS2转移1mol电子,则生成12g FeS2转移的电子数为$\frac{12g}{120g/mol}$×NA=0.1NA,故答案为:0.1NA;
②反应Ⅱ的离子方程式为CuS+2Cl-+Cu2+═S+2CuCl,故答案为:CuS+2Cl-+Cu2+═S+2CuCl;
③反应Ⅲ通入空气的目的是将反应Ⅱ生成的一价铜离子氧化成二价铜离子,故答案为:将反应Ⅱ生成的一价铜离子氧化成二价铜离子.
点评 本题考查较综合,涉及盖斯定律计算反应热、化学平衡计算及混合物分离提纯综合应用,注重高频考点的考查,把握物质的性质及相关反应原理为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

S2O82-+2I-═2SO42-+I2 ①慢
I2+2S2O32-═S4O62-+2I- ②快
下列说法正确的是( )
| A. | 总反应速率由反应②决定 | |
| B. | 在(NH4)2S2O8消耗完后,溶液显蓝色 | |
| C. | 若能观察到蓝色出现,则起始时,n(Na2S2O3)=n[(NH4)2S2O8] | |
| D. | 0~t s内,v(S2O82-)=v(S2O32-) |
| A. | MnO4-→Mn2+ | B. | NaCl→AgCl | C. | SO32-→SO42- | D. | Cu2+→Cu |
 铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任.
铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任. .一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.
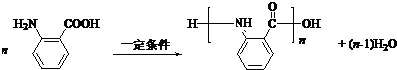
.一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.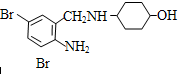 ,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)

 .
. .
. .
.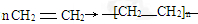 .
.