题目内容
14. 铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任.
铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任.(1)铁在元素周期表中的位置是第四周期第VIII族.
(2)钢铁在潮湿的空气中易发生电化学腐蚀,且与空气的接触面积越大,腐蚀程度越大,写出钢铁腐蚀过程中正极的反应式O2+4e-+2H2O=4OH-.
(3)在生铁中含有一种仅由铁、碳两种元素组成的化合物X.已知X中铁、碳元素的质量比为14:1,X的最简式为Fe3C.
(4)X有如图转化关系(无关物质已经略去):[X]$→_{高温煅烧}^{足量氧气}$[固体Y]$\stackrel{过量盐酸}{→}$[溶液甲]$\stackrel{双氧水}{→}$[溶液乙]
①溶液甲中含有的阳离子是Fe2+Fe3+H+,向溶液甲中加入双氧水发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O
②将溶液乙加热、蒸干、灼烧后得到的固体是Fe2O3.
(5)X与过量的浓硝酸反应生成气体Z和气体W,Z是一种空间构型为直线型的分子,其电子式为
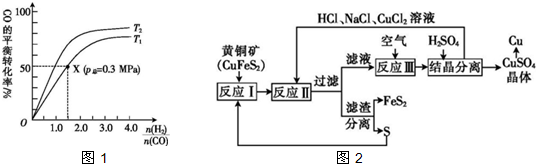
 .一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.
.一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.
分析 (1)铁是26号元素,四个电子层,最外层2个电子,在周期表中位于第四周期第ⅤⅢ;
(2)钢铁腐蚀过程中正极上是氧气得到电子发生还原反应;
(3)X中铁、碳元素的质量比为14:1,计算物质的量之比得到最简比写出最简式;
(4)转化关系可知(3)得到X的化学式在足量氧气中高温煅烧得到四氧化三铁,加入过量盐酸溶解得到氯化铁、氯化亚铁溶液甲,加入双氧水氧化亚铁离子为铁离子得到溶液乙为氯化铁溶液,加热蒸干灼烧乙溶液促进水解得到水解产物氢氧化铁,灼烧分解为氧化铁;
(5)温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2;温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,根据起始加入2molNO2计算混合气体总质量,计算混合气体的平均摩尔质量确定平均相对分子质量.
解答 解:(1)铁是26号元素,四个电子层,最外层2个电子,在周期表中位于第四周期第ⅤⅢ族,
故答案为:第四周期第VIII族;
(2)钢铁腐蚀过程中正极上是氧气得到电子发生还原反应,电极反应为:O2+4e-+2H2O=4OH-,
故答案为:O2+4e-+2H2O=4OH-;
(3)在生铁中含有一种仅由铁、碳两种元素组成的化合物X.已知X中铁、碳元素的质量比为14:1,物质的量之比=$\frac{14}{56}$:$\frac{1}{12}$=3:1,最简式为:Fe3C,
故答案为:Fe3C;
(4)转化关系可知(3)得到X的化学式Fe3C,在足量氧气中高温煅烧得到四氧化三铁,二氧化碳,固体加入过量盐酸溶解得到氯化铁、氯化亚铁溶液甲,
①溶液甲中含有的阳离子是Fe2+ Fe3+ H+,加入双氧水氧化亚铁离子为铁离子得到溶液乙为氯化铁溶液,反应的离子方程式为:2Fe2++H2O2+2 H+=2Fe3++2H2O,
故答案为:Fe2+ Fe3+ H+,2Fe2++H2O2+2 H+=2Fe3++2H2O;
②加热蒸发氯化铁溶液,氯化铁水解生成氢氧化铁和盐酸,氯化氢挥发,促进水解得到水解产物氢氧化铁,灼烧后得到的固体是氧化铁,化学式为:Fe2O3,
故答案为:Fe2+ Fe3+ H+,2Fe2++H2O2+2 H+=2Fe3++2H2O,Fe2O3;
(5)X与过量的浓硝酸反应生成气体Z和气体W,Z是一种空间构型为直线型的分子,判断Z为CO2,二氧化碳中碳原子和氧原子分别写出两个共用电子对,电子式为: ,W为NO2,温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2,方程式为:2NO2?2NO+O2,
,W为NO2,温度由T1继续升高到T2的过程中,气体逐渐变为无色,且混合气体总的物质的量增大,说明NO2发生分解反应,应生成NO与O2,方程式为:2NO2?2NO+O2,
温度在T2-T3之间处于平衡状态,平衡时混合气体总的物质的量为3mol,起始加入2molNO2,故平衡混合气体总质量=2mol×46g/mol=92g,混合气体的平均摩尔质量=$\frac{92g}{3mol}$=30.7g/mol,故混合气体的平均相对分子质量为30.7,
故答案为:30.7.
点评 本题考查了铁及其化合物性质的分析主要是化学式、反应产物的分析判断,反应现象和图象分析是解题关键,题目难度中等.

| A. | NO2能支持燃烧 | |
| B. | NO2不能支持燃烧 | |
| C. | 木条复燃是因为硝酸铜分解产生了氧气的缘故 | |
| D. | 不能判断NO2是否支持燃烧 |
| A. | 油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离 | |
| B. | 可用水鉴别己烷、四氯化碳、甲酸三种无色液体 | |
| C. | 电石和饱和食盐水制乙炔的实验中,用氢氧化钠溶液除去全部气体杂质 | |
| D. | 苯和浓溴水在铁存在下制溴苯 |
| A. | 合成纤维、人造纤维可统称为化学纤维 | |
| B. | 酚醛树脂和聚氯乙烯都是热固性塑料 | |
| C. | 合成纤维“六大纶”中吸湿性最好的是锦纶 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 稀硫酸 | 蒸发结晶 |
| B | CO2(CO) | O2 | 点燃 |
| C | Zn (Ag) | 稀盐酸 | 过滤 |
| D | 自来水(Cl-) | --- | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
 科学家预言,燃料电池将是21世纪获得电能的重要途径.
科学家预言,燃料电池将是21世纪获得电能的重要途径.