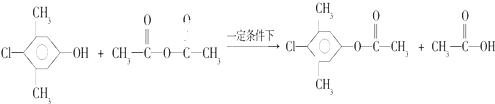
题目内容
13.已知下列3个反应:2FeCl3+2KI═2FeCl2+2KCl+I2,2FeCl2+Cl2═2FeCl3,KClO3+6HCl═3Cl2↑+3H2O+KCl.若某溶液中有FeCl2和FeI2同时存在,要氧化I而得到FeCl2溶液,应加入适量( )| A. | FeCl3 | B. | Cl2 | C. | KClO3 | D. | HCl |
分析 依据反应2FeCl3+2KI═2FeCl2+2KCl+I2,2FeCl2+Cl2═2FeCl3,KClO3+6HCl═3Cl2↑+3H2O+KCl,氧化剂的氧化性KClO3>Cl2>FeCl3>I2,若某溶液中有FeCl2和FeI2同时存在,要氧化I而得到FeCl2,则氧化剂只能I-,据此分析判断.
解答 解:依据反应2FeCl3+2KI═2FeCl2+2KCl+I2,2FeCl2+Cl2═2FeCl3,KClO3+6HCl═3Cl2↑+3H2O+KCl,氧化剂的氧化性KClO3>Cl2>FeCl3>I2,若某溶液中有FeCl2和FeI2同时存在,要氧化I而得到FeCl2,I->Fe2+,则氧化剂只能I-,不氧化Fe2+,
A、FeCl3能氧化I-不能氧化Fe2+,故A正确;
B、过量Cl2能氧化I-、Fe2+,不能只得到FeCl2溶液,故B错误;
C、KClO3是强氧化剂,可以氧化I-、Fe2+,不能只得到FeCl2溶液,故C错误;
D、HCl不能氧化碘离子,故D错误;
故选A.
点评 本题考查了物质的氧化性大小比较,离子性质的分析判断.掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
4.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 稀硫酸 | 蒸发结晶 |
| B | CO2(CO) | O2 | 点燃 |
| C | Zn (Ag) | 稀盐酸 | 过滤 |
| D | 自来水(Cl-) | --- | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
1.下列物质的水溶液导电性最强的是( )
| A. | 0.50mol•L-1 H2SO4溶液 | B. | 0.50mol•L-1 KNO3 溶液 | ||
| C. | 0.50mol•L-1酒精溶液 | D. | 0.50mol•L-1NaOH溶液 |
8.等物质的量的二氧化碳和氧气,在标准状况下相同的是( )
| A. | 质量 | B. | 所含分子数 | C. | 所含原子数 | D. | 摩尔质量 |
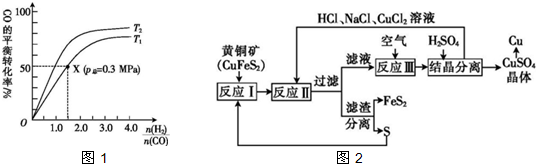
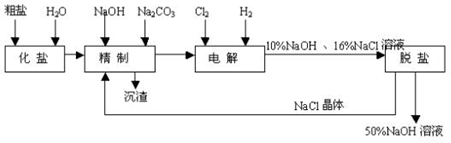
 .
.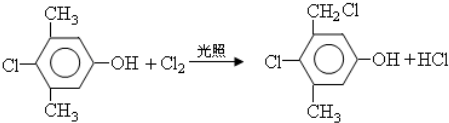
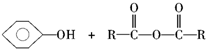 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$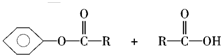
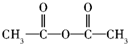 反应的化学方程式是
反应的化学方程式是