题目内容
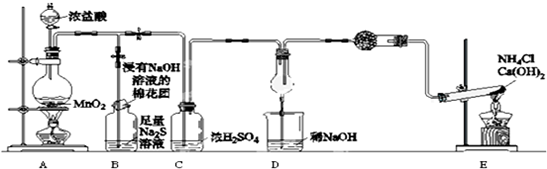
6. 乙酸正丁酯是一种重要化工原料,某实验小组利用图1、图2装置合成乙酸正丁酯(夹持装置已略去),发生的化学反应为:
乙酸正丁酯是一种重要化工原料,某实验小组利用图1、图2装置合成乙酸正丁酯(夹持装置已略去),发生的化学反应为:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
可能用到的有关数据见下表:
| 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解度 | |
| 正丁醇 | 74 | 117.2 | 0.80 | 微溶 |
| 乙酸 | 60 | 118.1 | 1.05 | 易溶 |
| 乙酸正丁酯 | 116 | 126.5 | 0.90 | 微溶 |
①在圈1的圆底烧瓶中,装入7.Og正丁醇和7.Og冰醋酸,再加入3-4滴浓硫酸.
②如图1所示,安装分水器和回流冷凝管.加热圆底烧瓶,待反应基本完成后,停止加誊
③冷却后将分水器中分出的酯层和圆底烧瓶中的反应液一起倒入分液漏斗中.先后用水、10%碳酸钠溶液洗涤.分离得到的酯层再用水洗涤后倒入锥形瓶中,加无水硫酸镁干燥.
④将干燥后的酯层倒入图2的蒸馏烧瓶中,加热蒸馏.收集124℃-126℃的馏分,称得质量为7.0g.
回答下列问题:
(1)图2冷凝管中冷水从b口流入(用字母表示);仪器d的名称是尾接管.
(2)分液漏斗使用前须检漏并洗净备用.分离上下层液体时,应先打开分液漏斗上端的玻璃塞,然后打开活塞放出下层液体,上层液体从上口倒出.
(3)实验中产生的副产物的结构简式为CH3CH2CH=CH2(任写一种).用10%碳酸钠溶液洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
(4)实验中国1圆底烧瓶c的容积最适合的是B(选填字母).
A.25mL B.50mL C.250mL D.500mL
(5)分水器中预先加水至略低于支管口.在加热过程中,除去生成水的操作是打开分水器下端的活塞,让水流出:判断
反应基本完成的标志是分水器中水面高度基本不再变化.
(6)实验中,乙酸正丁酯的产率为63.8%.
分析 (1)冷凝作用的仪器是冷凝管,水从下口进上口出;仪器d为蒸馏装置中的尾接管;
(2)分液漏斗使用前需要检漏,分离上下层液体时遵循“上吐下泻”的原则;
(3)加热过程中正丁醇发生消去反应生成正丁烯,乙酸丁酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应而被吸收;
(4)在圈1的圆底烧瓶中,装入7.Og正丁醇和7.Og冰醋酸,再加入3-4滴浓硫酸.正丁醇密度为0.80g/cm3,冰醋酸密度1.05g/cm3,溶液体积=$\frac{7g}{0.8g/c{m}^{3}}$+$\frac{7.0g}{1.05g/c{m}^{3}}$=15.42ml,据此分析选择烧瓶规格;
(5)除去分水器中的水,打开下端活塞放出,减少生成物能促进平衡向正反应方向移动,根据分水器中水位判断反应基本完成;
(6)实验过程中收集124℃-126℃的馏分,称得质量为7.0g为实际得到乙酸正丁酯的质量,产率=$\frac{实际量}{理论量}$×100%.
解答 解:(1)为提高冷凝效果,水应从下口进上口出,仪器d为蒸馏装置中的尾接管,
故答案为:b,尾接管;
(2)分液漏斗使用前需要检漏,分液操作时,使用的漏斗是分液漏斗,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以免两种液体相互污染,分离上下层液体时,应先打开分液漏斗上端的玻璃塞,然后打开活塞放出下层液体,上层液体从上口倒出,
故答案为:检漏,打开分液漏斗上端的玻璃塞;
(3)加热过程中正丁醇发生消去反应生成正丁烯,副产品为:CH3CH2CH=CH2,制备乙酸丁酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸丁酯的香味,溶解挥发出来的乙醇;降低乙酸丁酯在水中的溶解度,便于分层得到酯,
故答案为:CH3CH2CH=CH2,除去产品中含有的乙酸、硫酸等杂质;
(4)在圈1的圆底烧瓶中,装入7.Og正丁醇和7.Og冰醋酸,再加入3-4滴浓硫酸.正丁醇密度为0.80g/cm3,冰醋酸密度1.05g/cm3,溶液体积=$\frac{7g}{0.8g/c{m}^{3}}$+$\frac{7.0g}{1.05g/c{m}^{3}}$=15.42ml,最合适的烧瓶为50ml,
故答案为:B.
(5)分水器中预先加水至略低于支管口.在加热过程中,除去生成水的操作是打开分水器下端的活塞,让水流出,判断反应基本完成的标志是分水器中水面高度基本不再变化,
故答案为:打开分水器下端的活塞,让水流出,分水器中水面高度基本不再变化;
(6)实验过程中收集124℃-126℃的馏分,称得质量为7.0g为实际得到乙酸正丁酯的质量,依据化学方程式计算理论产量,设反应的乙酸物质的量为y,生成酯物质的量为x,
乙酸和正丁醇的反应方程式为CH3COOH+CH3CH2CH2CH2OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOCH2CH2CH2CH3+H2O
60g 74g 116g 18g
yg 7.0g xg
y=5.8g<7.0g 所以乙酸过量,按照正丁醇的质量计算产物,
x=10.97g,
产率=$\frac{实际量}{理论量}$×100%=$\frac{7.0g}{10.97g}$×100%=63.8%,
故答案为:63.8%.
点评 本题主要考查了乙酸乙酯的制,掌握乙酸乙酯的制备原理以及运用原理理解实验装置是解答的关键,题目难度中等.试题充分培养了学生的分析、理解能力及灵活应用所学知识的能力.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案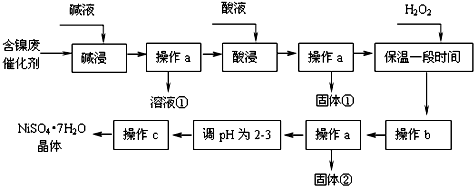
部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:3.2-7.2.
(5)“调pH为2~3”的目的是防止在浓缩结晶过程中Ni2+水解
(6)操作c的方法是:蒸发浓缩、冷却结晶、过滤
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ①②③④ |
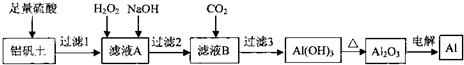
已知:
| 氢氧化物 | 开始沉淀pH | 沉淀完全pH | 开始溶解pH | 溶解完全pH |
| Fe(OH)3 | 2.3 | 4.1 | 14 | - |
| Al(OH)3 | 2.3 | 5.2 | 7.8 | 10.8 |
(2)加入H202时,发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.要检验Fe2+是否反应完全应选择的试剂是KMnO4.(供选试剂:KMn04溶液、KSCN溶液、NaOH溶液、H202溶液).加入NaOH调节滤液A的pH在10.8--14范围.
(3)流程中有多次过滤,需制作一个简单的过滤器,所需的用品有漏斗,滤纸
(4)电解Al2O3时阳极生成的02全部与石墨反应转化为C02和CO.相关反应的热化学 方程式如下:
C(s,石墨)+02(g)=C02(g)△H=-393.5kJ•mol-1
2C(s,石墨)+02(g)=2C0(g)△T=-221.0kJ•mol-1
若C02和CO的体积比为1:1,当阴极得到27g铝时,若阳极生成的气体用作燃料能放出热量141.5 kJ.
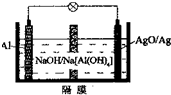
(5)新型铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池正极反应式为AgO+H2O+2e-=Ag+2OH-.
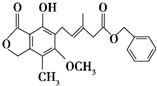
| A. | 既可与Br2的CCl4溶液发生加成反应,又可在光照条件下与Br2发生取代反应 | |
| B. | 1mol该有机物最多可与3molNaOH反应 | |
| C. | 既可催化加氢,又可使酸性KMnO4溶液褪色 | |
| D. | 既可与FeCl3溶液发生显色反应,又可与NaHCO3溶液反应放出CO2气体 |
| A. | RaCl2的分子量更大,熔沸点比CaCl2高 | |
| B. | Ra元素位于元素周期表中第六周期ⅡA族 | |
| C. | Ra(OH)2是一种两性氢氧化物 | |
| D. | 一个22688Ra原子中含有138个中子 |
| A. | X与M的原子序数之差为31 | |
| B. | Y的离子半径小于Z的离子半径 | |
| C. | 由X与Z组成的化合物,可与水反应放出X2 | |
| D. | 由M与Y组成的化合物,其水化物是强酸 |