题目内容
下列与金属腐蚀有关的说法正确的是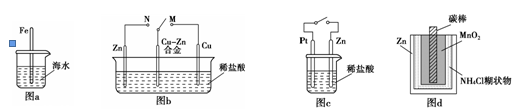
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu?Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
B
解析试题分析:A、图a中,插入海水中的铁棒,空气与海水交界处铁棒腐蚀最严重,错误;B、图b中,开关由M改置于N时,Zn作负极,Cu?Zn合金作正极,腐蚀速率减小,正确;C、图c中,接通开关形成原电池,Pt作正极,H+得电子生成氢气,Zn电极上无气体产生,错误;D、Zn-MnO2干电池自放电腐蚀主要是因为,制作电池的材料含有杂质,在电池内部形成原电池反应而自放电,错误。
考点:本题考查原电池原理、金属的腐蚀。

练习册系列答案
相关题目
银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是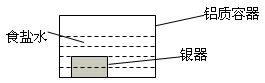
| A.该处理过程中电能转化为化学能 |
| B.银器为正极,Ag2S还原为单质银 |
| C.Ag2S溶解于食盐水生成了AgCl |
| D.铝质容器为阳极,其质量变轻 |
下图为一原电池装置,下列叙述中正确的是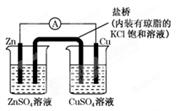
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的K+ 移向ZnSO4溶液 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
锌—空气电池可能成为未来的理想动力源,该电池的电解质溶液可以是酸性或碱性。在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2=2Na2ZnO2 +2H2O。下列有关锌-空气电池说法正确的是
| A.碱性电解质溶液中正极反应式为:4OH-- 4e-= O2↑+2H2O |
| B.碱性或酸性电解质溶液中,该电池正极反应式相同 |
| C.该电池工作时,Na+移向负极 |
| D.每生成1 mol ZnO22-转移电子数为2NA |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 +Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 | B.负极的电极反应式为:Pb+SO42--2e– = PbSO4 |
| C.PbO2得电子,被氧化 | D.电池放电时,溶液酸性增强 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
| A.负极发生的反应为:Fe-2e-===Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-=4OH- |
| C.钢和铁都是铁合金,所以它们的组成基本相同 |
| D.插在水中的钢柱在水下部分比在空气与水交界处更容易腐蚀 |
下列有关铜锌原电池(如图)的叙述正确的是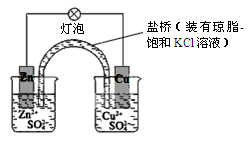
| A.正极反应为Zn-2e-=Zn2+ |
| B.电池反应为Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.取下盐桥,原电池仍可工作 |
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
| A.电能全部转化为化学能 |
| B.粗铜接电源正极,发生还原反应 |
| C.溶液中Cu2+向阳极移动 |
| D.利用阳极泥可回收Ag、Pt、Au等金属 |