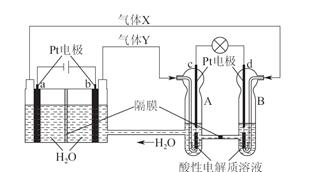
题目内容
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
| A.负极发生的反应为:Fe-2e-===Fe2+ |
| B.正极发生的反应为:2H2O+O2+2e-=4OH- |
| C.钢和铁都是铁合金,所以它们的组成基本相同 |
| D.插在水中的钢柱在水下部分比在空气与水交界处更容易腐蚀 |
A
解析试题分析:钢铁在潮湿的空气中形成原电池,.负极发生的反应为:Fe-2e-=Fe2+;正极发生的反应为:2H2O+O2+4e-=4OH-;钢柱在空气与水交界处最容易腐蚀;生铁、钢的含碳量及其它杂质的含量不同,所以BCD错误,A正确。
考点:钢铁的吸氧腐蚀

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用惰性电极电解CuSO4溶液一段时间后,停止电解,向所得溶液中加入0.1 mol Cu(OH)2,溶液浓度恢复至电解前。关于该电解过程的说法不正确的是
| A.生成Cu的物质的量是0.1 mol |
| B.转移电子的物质的量是0.2 mol |
| C.随着电解的进行溶液的pH减小 |
| D.阳极反应式是4OH--4e-=2H2O+O2↑ |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:电池 Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)
电解池 2Al + 3H2O = Al2O3 + 3H2,对该电解过程,以下判断正确的是
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成1molAl2O3 |
| C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O—6e—=Al2O3+6H+ |
| D | Pb电极反应质量不变 | Pb电极反应质量不变 |
不能用Fe+H2SO4=FeSO4+H2↑表示的是( )
| A.用导线将铁片和铜片连接后,放入一盛有稀 H2SO4溶液的烧杯中 |
| B.将铁片直接放入一盛有稀 H2SO4溶液的烧杯中 |
| C.Cu片作阳极,铁片作阴极,电解一定量的H2SO4溶液 |
| D.Cu片作阴极,铁片作阳极,电解一定量的H2SO4溶液 |
下列与金属腐蚀有关的说法正确的是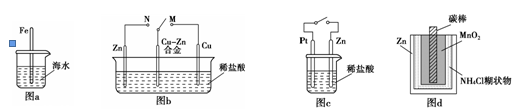
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu?Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
如图为用惰性电极电解CuCl2溶液并验证其产物的实验装置,则下列说法不正确的是( )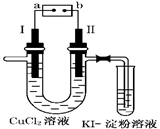
| A.电源a极为负极 |
| B.KI—淀粉溶液会变蓝色 |
| C.若加入适量CuCl2可使电解后的溶液恢复原状态 |
| D.电极Ⅰ上发生的电极反应为:Cu-2e-=Cu2+ |
下列说法中正确的是
| A.在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B.粗铜精炼时,电镀液中的c(Cu2+)保持不变 |
| C.纯银在空气中久置变黑发生的是电化学腐蚀 |
| D.阴极电保护法是将被保护的金属与外加电源的正极相连 |