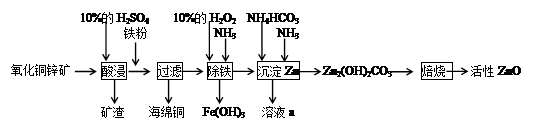题目内容
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y·zH2O。某校化学兴趣小组欲测定其化学式,实验设计如下:
实验I:称取一定质量的A,加热分解至恒重。
实验Ⅱ:称取一定质量的A与足量的酸反应,测量生成CO2气体的质量。
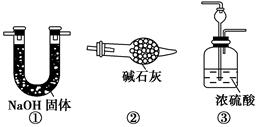
可供选择的仪器和药品如图所示:(酸溶液限选6mol/LHCl或6mol/LH2SO4,其它试剂任选。)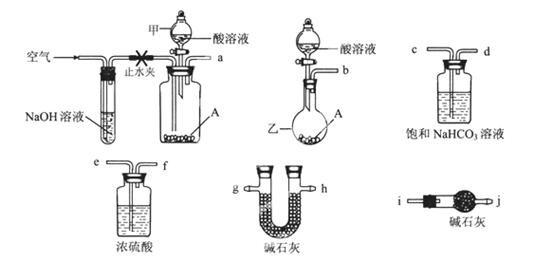
回答下列问题:
(1)仪器乙的名称为________。
(2)请选择必要的装置完成实验II,正确的连接顺序为________ (按气流方向,用接口字母表示);选用的酸溶液是________。
(3)有人提出不采用实验I,可在实验II结束后,在A完全反应后所得溶液中滴加足量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2?3次,将洗涤液过滤,洗涤沉淀2?3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是_________________,实际上未采用该方案的原因是不符合实验设计的________原则(填字母编号)。
| A.科学性 | B.安全性 | C.可行性 | D.简约性 |
(5)通过实验I的相关数据,经计算可得A的摩尔质量为602.0g. mol-1。实验II中称得样品A的质量为9.030g,与足量酸完全反应后,CO2吸收装置增重0.660g,则A 的化学式为________。
(1)圆底烧瓶(2分) (2)a→e,f→g,h(或h,g)→i (2分) 6mol/LH2SO4
(3)取少量末次沉淀洗涤液于试管中,滴加氯化钡溶液后吴浑浊,说明沉淀已洗涤干净(2分,合理即可) D(2分) (4)x+2y=18(或x=16y)(2分) (5)Al2Mg6(OH)16CO3·4H2O(2分)
解析试题分析:(1)根据仪器的结构特点可知,仪器乙的名称为圆底烧瓶。
(2)要准确测量反应中生成的CO2,则需要除去装置中残留的空气,因此反应前需要利用空气排尽装置的中的空气。由于空气中含有CO2因此空气要首先通过氢氧化钠溶液除去空气中的CO2。又因为反应中生成的CO2含有水蒸气,所以还需要先通过浓硫酸除去水蒸气,最后再通过碱石灰吸收CO2。同时为了防止空气中的CO2也被吸收,还需要再连接有个盛有碱石灰的干燥管或U形管,因此正确的连接顺序是)a→e,f→g,h(或h,g)→i。由于盐酸易挥发,所以应该选择6mol/L的硫酸。
(3)由于滤液中含有42-,因此可以通过检验42-来检验沉淀是否洗涤干净,即取少量末次沉淀洗涤液于试管中,滴加氯化钡溶液后吴浑浊,说明沉淀已洗涤干净;根据A的组成阳离子可知,生成的沉淀是氢氧化镁和氢氧化铝,但由于沉淀的生成、过滤、洗涤、干燥、称量过程过于复杂,因此实际上未采用该方案的原因是不符合实验设计的简约性,答案选D。
(4)根据化学式Al2Mg6(OH)x(CO3)y·zH2O并依据化合价代数和为0可知,x+2y=3×2+2×6=18。
(5)CO2吸收装置增重0.660g,则CO2的物质的量=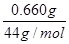 =0.015mol
=0.015mol
9.030g样品的物质的量= =0.015mol
=0.015mol
所以根据原子守恒可知y=1
则x=18-2y=16
所以z=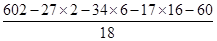 =4
=4
因此该物质的化学式为Al2Mg6(OH)16CO3·4H2O
考点:考查仪器识别、物质的除杂、化学式确定的实验方案设计与评价以及有关计算

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
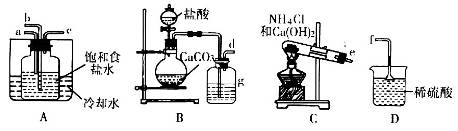
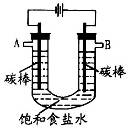
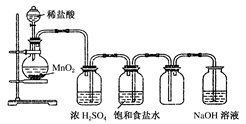
学练快车道口算心算速算天天练系列答案如图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和NH4Cl饱和溶液反应制取N2,N2和H2混合后通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,则说明产生了氨气。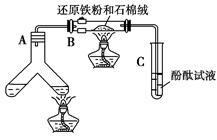
某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生如下反应:
①NaNO2+NH4Cl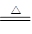 NH4NO2+NaCl
NH4NO2+NaCl
②NH4NO2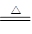 NH3↑+HNO2
NH3↑+HNO2
③2HNO2 N2O3↑+H2O
N2O3↑+H2O
④2NH3+N2O3 2N2+3H2O
2N2+3H2O
信息二:查阅资料,不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞试液变红所需要的时间如下:
| N2和H2的体积比 | 5∶1 | 3∶1 | 1∶1 | 1∶3 | 1∶5 |
| 酚酞变红色所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式________________________。
(2)铁粉撒在石棉绒上的目的是_________________________________
(3)课外活动小组的同学们认为,该实验中即使酚酞变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是________________________。
请你另设计一个简单的实验验证你的理由____________________。欲解决这一问题,可以选用下图中的________装置连接在原装置中的________和________之间。
(4)在上述实验过程中,为尽快观察到酚酞试液变红的实验现象,应该控制N2和H2的体积比为________比较适宜;但该装置还难以实现此目的,原因是______________________________________。
(5)实验过程中通入试管C中的气体成分有________。