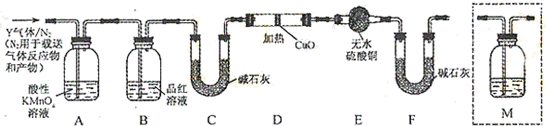
题目内容
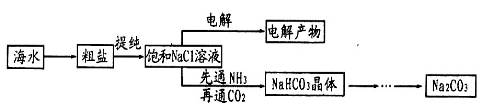
(1)某厂利用生产磷铵排放的磷石膏废渣制硫酸联产水泥,硫酸返回用于生产磷铵。其生产流程图如下: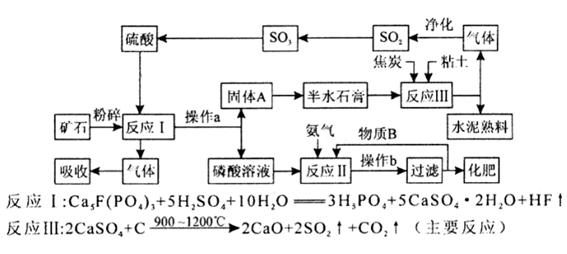
①操作b的名称是浓缩、冷却、 。
②如反应II的产物是两种酸式盐,则物质B中溶质的化学式是 。
③若在实验室中对反应II产生的气体用 吸收。
④该生产流程最大的优点是尽可能地实现原料的循环使用和副产物的综合利用,该生产流程体现的基本思想是 。
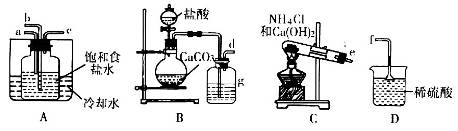
(2)为测定同体磷铵化肥中铵态氮的质量分数,实验室用下图所示装置进行实验。实验时,在A中加入mg磷铵样品,关闭止水夹a.打开止水夹b,向A中加入足量的浓NaOH溶液,完全反应后C中浓硫酸增重ng。请回答下列问题: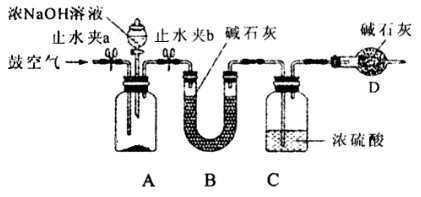
①试说明检查该装置气密性的操作方法和实验现象 。
②装置B的作用是 ,装置D的作用是 。
③实验过程应该在何时鼓入空气?答: (填“开始前”、“过程中”或“反应后”)
④如某次测定的铵态氮的质量分数明显偏低,则可能的原因是 (填字母)。
| A.磷铵样品与氢氧化钠未充分反应 | B.A和B中残留了一定量的氨气 |
| C.氢氧化钠溶液的浓度太大 | D.鼓气过快 |
(1)①结晶(2分)
②NH4H2PO4 (NH4)2HPO4(2分)
③NaOH溶液(2分)
④绿色化学(2分)
(2)①先在D的右边连上一段胶管并用止水夹密闭,然后关闭止水夹a、打开止水夹b,再向分液漏斗中加水打开活塞,若水流一段时间后不再流下,则装置不漏气,否则就漏气(2分)
②吸收混在氨气中的水分(2分)防止空气中的水蒸汽进入装置C中(2分)
③完全反应后(2分)
④A、B、D(2分)
(对一个或两个给1分,全对给2分,但只要出现C不给分)
⑤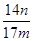 ×100%(2分)
×100%(2分)
H3PO4 CaSO4·2H2O CO2 SO2 HF NH4H2PO4 (NH4)2HPO4 结晶 过滤
解析试题分析:(1)①反应Ⅱ是NH3和H3PO4反应生成NH4H2PO4、(NH4)2HPO4,通过浓缩、冷却、结晶和过滤后得到晶体,答案:结晶(2分)
②如反应II的产物是两种酸式盐,H3PO4是三元酸,能形成两种酸式盐:NH4H2PO4 (NH4)2HPO4,则物质B中溶质的化学式是NH4H2PO4 (NH4)2HPO4,答案:NH4H2PO4 (NH4)2HPO4(2分)
③在实验室中对反应Ⅲ产生的气体HF,可用NaOH溶液来吸收,HF+NaOH=NaF+H2O,答案:NaOH溶液(2分)
④利用化学原理从源头上减少和消除工业生产对环境的污染;反应物的原子全部转化为期望的最终产物,这是绿色化学思想的核心,答案:绿色化学 ;(2分)
(2)①检查该装置气密性,可以用压水法,答案:先在D的右边连上一段胶管并用止水夹密闭,然后关闭止水夹a、打开止水夹b,再向分液漏斗中加水打开活塞,若水流一段时间后不再流下,则装置不漏气,否则就漏气(2分)
②装置B中的碱石灰具体有吸水性,吸收混在氨气中的水分(2分)装置D的作用:C中浓H2SO4具有吸水性,防止空气中的水蒸汽进入装置C中,减小实验误差。答案:吸收混在氨气中的水分(2分)防止空气中的水蒸汽进入装置C中(2分)
③在反应完全进行后,鼓入空气,将NH3赶入C中,以减小测量误差,答案:完全反应后(2分)
④A、正确,磷铵样品与氢氧化钠未充分反应,浓硫酸吸收的氨减少,测得的氮的质量分数偏低;B、正确,A和B中残留了一定量的氨气,浓硫酸吸收的氨减少,测得的氮的质量分数偏低;C、不正确,氢氧化钠溶液的浓度大更利于氨气的逸出;D、不正确,鼓气过快,氨气来不及被浓硫酸吸收,测得的氮的质量分数偏低;答案:A、B、D(2分)
(对一个或两个给1分,全对给2分,但只要出现C不给分)
⑤完全反应后C中浓硫酸增重ng,是氨气的质量,氮的质量为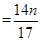 g,mg固体磷铵化肥中铵态氮的质量分数为
g,mg固体磷铵化肥中铵态氮的质量分数为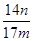 ×100%,答案:
×100%,答案: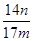 ×100%(2分)
×100%(2分)
考点:实验设计与评价、绿色化学、元素及化合物

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案铁在冷的浓硫酸中能发生钝化现象。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
(1)证明反应所产生的气体中有SO2生成的现象是 。
(2)证明气体中含有氢气的实验现象是 。
(3)为了进一步探究反应后A溶液中铁元素的价态,他们进行了如下的假设:
假设1:溶液中铁元素既有Fe3+也有Fe2+
假设2:溶液中铁元素只有Fe3+
假设3:溶液中铁元素只有________________
基于假设1,现有试剂:0.01 mol/L酸性KMnO4溶液、稀溴水溶液、0.1 mal/L KI溶液、
淀粉溶液、KSCN溶液,蒸馏水。请探究其所得溶液。请完成表中内容。
【实验探究】
| 实验操作 | 预期现象 | 结论 |
| 取反应后的A溶液分装在a、b两试管,步骤①:往a试管中滴入 。 | | |
| 步骤②:往b试管中滴入 。 | | 溶液含有Fe3+ |
化学与生产、生活、社会密切相关。下列有关说法中,错误的是
| A.服用铬含量超标的药用胶囊,会对人体健康造成危害 |
| B.血液透析是利用了胶体的性质 |
| C.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D.厨房中燃气泄漏,立即打开抽油烟机排气 |

 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。