题目内容
【题目】(1)已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
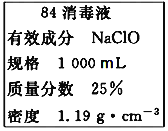
①该“84消毒液”的物质的量浓度约为___mol·L-1。(保留小数点后一位)
②某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(2)从矿物学资料查得,二硫化亚铁和硫酸铜在一定条件下发生反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。
当有2.5molFeS2参加反应时,氧化产物的物质的量为__mol,转移的电子__mol。
【答案】4.0 0.04 1.5 10.5
【解析】
根据题中84消毒液的标签可知,本题考查配制一定物质的量浓度的溶液的相关计算,根据![]() 及稀释前后溶质物质的量不变分析
及稀释前后溶质物质的量不变分析
① 根据25%NaClO、1000mL、密度1.19gcm-3,![]()
故答案为:4.0
②稀释前后溶质的物质的量不变,所以稀释后![]() ,
,
故答案为:0.04
(2)由 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4可知,反应中转移电子数和氧化产物(FeSO4)、FeS2的关系为:21e- ~3FeSO4~5FeS2, 因此当有2.5molFeS2参加反应时,氧化产物的物质的量为1.5mol,转移的电子10.5mol。
故答案为:1.5 10.5

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
【题目】一定温度下,在三个容积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]()
![]() ,测得反应的相关数据如下:
,测得反应的相关数据如下:
容器 | 容器Ⅰ | 容器Ⅱ | 容器Ⅲ |
反应温度 | 600 | 600 | 800 |
反应物投入量 |
|
|
|
平衡 |
|
|
|
平衡 |
|
|
|
平衡体系总压强 |
|
|
|
物质的转化率 |
|
|
|
平衡常数K |
|
|
|
下列叙述正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()