题目内容
【题目】(1)已知氯气通入热的苛性钠溶液中会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O反应中还原剂是___(填化学式);把此反应改写成离子方程式:___;
(2)用“双线桥”表示下列氧化还原反应中电子转移的方向和数目:3Cl2+6NaOH=5NaCl +NaClO3+3H2O。___
(3)若生成1mol的NaClO3,转移的电子数是___;若反应中转移了2.5mol的电子,则消耗标况下Cl2的体积是___。
【答案】Cl2 3Cl2+6OH-═5Cl-+ClO3-+3H2O 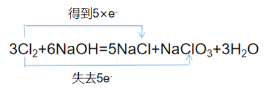 5NA 33.6L
5NA 33.6L
【解析】
反应方程式中共6个Cl原子,5个Cl原子得电子化合价降低,由0价降低到-1价,被还原,做氧化剂。 1个Cl原子失电子化合价升高,由0价升高到+5价,被氧化,做还原剂。
(1)由题意可知,Cl2的化合价升高,做还原剂,反应中的还原剂为Cl2,离子方程式为:3Cl2+6OH-═5Cl-+ClO3-+3H2O;
故答案为:Cl2 ;3Cl2+6OH-═5Cl-+ClO3-+3H2O
(2)5个Cl原子得5个电子,化合价由0价降低到-1价,1个Cl原子失去5个电子,化合价0价升高到+5价,用双线桥表示法表示为: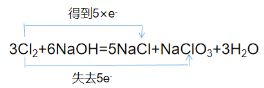 。
。
故答案为: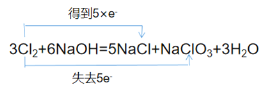 。
。
(3)由分析可知生成1mol的NaClO3,化合价由0价升高到+5价,需要转移5mol电子,即转移电子数为5NA,若反应中转移了2.5mol的电子,则消耗Cl2的物质的量为1.5mol,标况下1.5molCl2的体积为V=n×Vm=1.5mol×22.4mol/L=33.6L。
故答案为:5NA;33.6L

【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D