题目内容
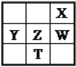
【题目】固体化合物X由3种元素组成。某学习小组进行了如下实验:

请回答:
(1) 由现象1得出化合物X含有________元素(填元素符号)。
(2) 固体混合物Y的成分________(填化学式)。
(3) X的化学式________。X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是________。
【答案】O Cu和NaOH NaCuO2 2NaCuO2+8HCl2NaCl+2CuCl2+Cl2↑+4H2O
【解析】
固体混合物Y溶于水,得到固体单质为紫红色,说明是Cu,产生碱性溶液,焰色反应呈黄色说明含有钠元素,与盐酸HCl中和,说明为NaOH(易算出为0.02mol),混合气体能使CuSO4变蓝,说明有水蒸汽。
(1)CuSO4由白色变为蓝色,说明有水生成,根据元素守恒分析,必定含有O元素。
(2)现象2获得紫色单质,说明Y含有Cu,现象3焰色反应为黄色说明有Na元素,与HCl发生中和反应说明有NaOH,故答案填Cu和NaOH。
(3)NaOH为0.02mol,易算出m(Na)=0.02×23g=0.46g,m(O)=m-m(Na)-m(Cu)=2.38-0.46-1.28=0.46g,N(Na):N(Cu):N(O)=![]() =1:1:2,故化学式为NaCuO2,X与浓盐酸反应,根据反应现象,产物有Cl2,和CuCl2蓝色溶液,因而化学方程式为2NaCuO2+8HCl2NaCl+2CuCl2+Cl2↑+4H2O
=1:1:2,故化学式为NaCuO2,X与浓盐酸反应,根据反应现象,产物有Cl2,和CuCl2蓝色溶液,因而化学方程式为2NaCuO2+8HCl2NaCl+2CuCl2+Cl2↑+4H2O

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某兴趣小组在定量分析了镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]中Mg含量的基础上,按如下流程制备六水合氯化镁(MgCl2·6H2O)。

相关信息如下:
①700℃只发生MgCO3和Mg(OH)2的分解反应。
②NH4Cl溶液仅与体系中的MgO反应,且反应程度不大。
③“蒸氨”是将氨从固液混合物中蒸出来,且须控制合适的蒸出量。
请回答:
(1) 下列说法正确的是________。
A.步骤Ⅰ,煅烧样品的容器可以用坩埚,不能用烧杯和锥形瓶
B.步骤Ⅲ,蒸氨促进平衡正向移动,提高MgO的溶解量
C.步骤Ⅲ,可以将固液混合物C先过滤,再蒸氨
D.步骤Ⅳ,固液分离操作可采用常压过滤,也可采用减压过滤
(2) 步骤Ⅲ,需要搭建合适的装置,实现蒸氨、吸收和指示于一体(用硫酸溶液吸收氨气)。
①选择必须的仪器,并按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):热源→________。

②为了指示蒸氨操作完成,在一定量硫酸溶液中加指示剂。请给出并说明蒸氨可以停止时的现象________。
(3) 溶液F经盐酸酸化、蒸发、结晶、过滤、洗涤和低温干燥得到产品。取少量产品溶于水后发现溶液呈碱性。
①含有的杂质是________。
②从操作上分析引入杂质的原因是________。
(4) 有同学采用盐酸代替步骤Ⅱ中的NH4Cl溶液处理固体B,然后除杂,制备MgCl2溶液。已知金属离子形成氢氧化物沉淀的pH范围:
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Al3+ | 3.0 | 4.7 |
Fe3+ | 1.1 | 2.8 |
Ca2+ | 11.3 | - |
Mg2+ | 8.4 | 10.9 |
请给出合理的操作排序(从下列操作中选取,按先后次序列出字母,操作可重复使用):固体B→a→(___)→(___)→(___)→(___)→(___)→(___)→MgCl2溶液→产品。
a.用盐酸溶解 b.调pH=3.0 c.调pH=5.0 d.调pH=8.5
e.调pH=11.0 f.过滤 g.洗涤