题目内容
【题目】向含有HCO3-、CO32-、NO3-、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减少的是( )
A.HCO3-B.CO32-C.NO3-D.Na+
【答案】A
【解析】
Na2O2与水反应生成NaOH和O2,反应后溶液成碱性,并且Na2O2具有强氧化性,凡是与NaOH或者与Na2O2发生氧化还原反应的离子浓度肯定发生变化,以此解答该题。
Na2O2与水反应生成NaOH和O2,反应后溶液成碱性,HCO3-在强碱性条件下转化为碳酸根离子,故其浓度减小,CO32-、Na+浓度增大,若忽略溶液体积的变化,浓度不变的只有NO3-,故答案选A。

练习册系列答案
相关题目
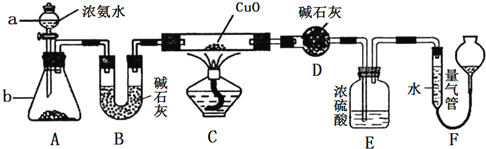
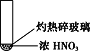
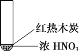
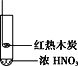
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为氧化产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应