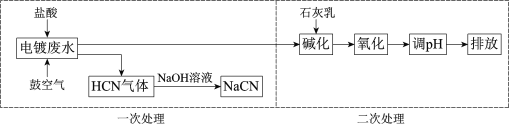
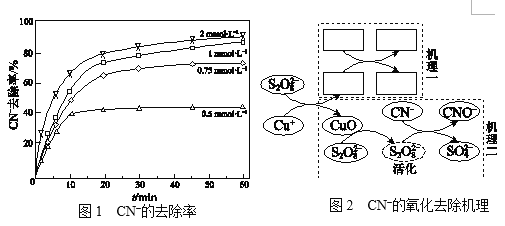
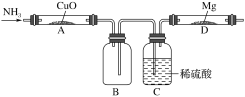
题目内容
【题目】下列说法正确的是( )
A.mA(g)+nB(g) ![]() pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
B.将一定量纯净的氨基甲酸铵置于密闭真空容器中,在恒定温度下使其分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
C.对于反应A(g)+B(g) ![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
D.2NO(g)+2CO(g) ![]() N2+2CO2在常温下能够进行,则反应的△H <0
N2+2CO2在常温下能够进行,则反应的△H <0
【答案】C
【解析】
A、平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,可知压强减小,平衡逆向移动;
B、生成物中氨气、二氧化碳的体积比始终为2:1;
C、该反应为气体体积不变的反应;
D、由化学计量数可知△S<0,△H-T△S<0的反应可自发进行。
A、平衡时A的浓度等于0.5mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,可知压强减小,平衡逆向移动,则化学计量数m+n>p,故A错误;
B、生成物中氨气、二氧化碳的体积比始终为2:1,CO2的体积分数始终不变,不能作为平衡判断的依据,故B错误;
C、该反应为气体体积不变的反应,平衡时A的体积分数为n%,此时若给体系加压,平衡不移动,则A的体积分数不变,故C正确;
D、由化学计量数可知△S<0,△HT△S<0的反应可自发进行,在常温下能自发进行,则该反应的△H<0,故D错误。

【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一。
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
②CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
(1)则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是_______,该反应的化学平衡常数K随温度的升高将_______(填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向____________(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为___________。