��Ŀ����
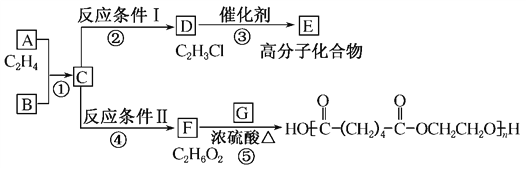
����Ŀ��A��B��C��D��E��F���ֻ��������A��B��C��D��E���ɶ�����Ԫ����ɣ���ɫ��Ӧ��Ϊ��ɫ��B��C��E��������Ԫ����ɣ�B��C�����Ԫ����ͬ����C��Ħ��������B��80g/mol���ش�
��1�����廯����AΪdz��ɫ��ĩ���û������к��еĻ�ѧ��Ϊ
A.���Ӽ�
B.���Թ��ۼ�
C.�Ǽ��Թ��ۼ�
D.���
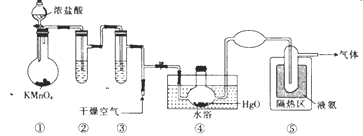
��2���±�ΪB��Fʵ��IJ�������
���ں�B����Һ�м���ϡH2SO4 �� ����dz��ɫ���Ǻ�ʹ����ʯ��ˮ����ǵ���ɫ�д̼�����ζ������ |
��20mL��ˮ�еμ�F�ı�����Һ1��2mL����Һ��ʺ��ɫ |
�۽�ʵ��ڵõ��ĺ��ɫҺ��������������գ����յõ�����ɫ���� |
д��B��ϡH2SO4��Ӧ�����ӷ���ʽ
д�����з�Ӧ�Ļ�ѧ����ʽ
��3������6������Mn2+��MnO ![]() ��H+��H2O��X2Y
��H+��H2O��X2Y ![]() ��C�к��е������ӣ���XY
��C�к��е������ӣ���XY ![]() ���һ�����ӷ���ʽ����֪Mn2+Ϊ��ԭ�����õ�1molMnO
���һ�����ӷ���ʽ����֪Mn2+Ϊ��ԭ�����õ�1molMnO ![]() �������������ʵ���Ϊmol
�������������ʵ���Ϊmol
��4��������D��E�ת��D ![]() E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊg��ExH2O�Ļ�ѧʽΪ ��
E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊg��ExH2O�Ļ�ѧʽΪ ��
���𰸡�
��1��AC
��2��S2O32��+2H+=S��+SO2��+H2O��FeCl3+3H2O ![]() Fe��OH��3�����壩+3HCl
Fe��OH��3�����壩+3HCl
��3��2.5
��4��8.4��Na2C03?7H2O
���������⣺��1.��A��B��C��D��E���ɶ�����Ԫ����ɣ���ɫ��Ӧ���ʻ�ɫ��������NaԪ�أ����廯����AΪdz��ɫ��ĩ�����ǹ������ƣ����������к������Ӽ��ͷǼ��Լ������Դ��ǣ�AC��
��2.�����ݢڢۿ�֪F���Ȼ�����Һ�����ݢٿ�֪B��Na2S2O3 �� B�����ᷴӦ�ķ���ʽΪ��S2O32��+2H+=S��+SO2��+H2O����������������������Ʊ�������ʽΪ��FeCl3+3H2O ![]() Fe��OH��3�����壩+3HCl�����Դ��ǣ�S2O32��+2H+=S��+SO2��+H2O��FeCl3+3H2O
Fe��OH��3�����壩+3HCl�����Դ��ǣ�S2O32��+2H+=S��+SO2��+H2O��FeCl3+3H2O ![]() Fe��OH��3�����壩+3HCl��
Fe��OH��3�����壩+3HCl��
��3.��Mn2+����������MnO4�� �� ���ϼ�����5����λ����������X2Y82һ �� �仹ԭ������SO42�� �� 1mol�������õ�2mol���ӣ����Ը��ݵ��ӵĵ�ʧ�غ��֪����Ҫ�����������ʵ����� ![]() =2.5mol�����Դ��ǣ�2.5mol��
=2.5mol�����Դ��ǣ�2.5mol��
��4.������ת����֪D��̼�����ƣ�EΪ̼���ƣ�Ũ�������ӵ���������ˮ�����������ʵ����� ![]() =0.19mol����ʯ�����ӵ�������CO2������������CO2�����ʵ�����
=0.19mol����ʯ�����ӵ�������CO2������������CO2�����ʵ����� ![]() =0.05mol����
=0.05mol����
2NaHCO3 ![]() Na2CO3+CO2��+H2O
Na2CO3+CO2��+H2O
0.1mol 0.05mol 0.05mol���D��NaHCO3�������ʵ�����0.1mol��������0.1mol��84g/mol=8.4g������Na2CO3XH2O��������13.04g��8.4g=4.64g�����Na2CO3XH2O�нᾧˮ�����ʵ�����0.19mol��0.05mol=0.14mol��������0.14mol��18g/mol=2.52g������Na2CO3XH2O��Na2CO3��������4.64g��2.52g=2.12g�������ʵ����� ![]() =0.02mol����n��Na2CO3����n��H2O��=0.02mol��0.14mol=1��7����EXH20�Ļ�ѧʽΪNa2C037H2O�����Դ��ǣ�8.4g��Na2C037H2O��
=0.02mol����n��Na2CO3����n��H2O��=0.02mol��0.14mol=1��7����EXH20�Ļ�ѧʽΪNa2C037H2O�����Դ��ǣ�8.4g��Na2C037H2O��