题目内容
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A.0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA
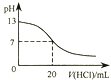
B.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH﹣数目为0.2NA
C.标准状况下,22.4LCHCl3含有的分子数为NA
D.1L 0.1molL﹣1的硫化钠溶液中硫离子数目为0.1NA
【答案】A
【解析】解:A.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,1mol氯气参加反应转移1mol电子,则0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA , 故A正确; B.pH=13,即C(H+)=10﹣13mol/L,C(OH﹣)= ![]() mol/L=0.1mol/L,根据n=CV=0.1mol/L×1.0L=0.1mol,个数为NA个,故B错误;
mol/L=0.1mol/L,根据n=CV=0.1mol/L×1.0L=0.1mol,个数为NA个,故B错误;
C.标况下,CHCl3为液体,不能使用气体摩尔体积,故C错误;
D.硫离子为多元弱碱离子,水溶液中部分水解,所以1L 0.1molL﹣1的硫化钠溶液中硫离子数目小于0.1NA , 故D错误;
故选:A.

【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。