题目内容
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是﹣285.8kJmlo﹣1﹣1411.0kJmlo﹣1和﹣1366.8kJmlo﹣1 , 则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.﹣44.2kJmol﹣1
B.+44.2kJmol﹣1
C.﹣330kJmol﹣1
D.+330kJmol﹣1
【答案】A
【解析】解:有题意可知: 氢气燃烧的热化学方程式为:①H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJ/mol;
O2(g)=H2O(l)△H=﹣285.8 kJ/mol;
C2H4(g)燃烧的热化学方程式为:②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=﹣1411.0kJ/mol;
C2H5OH(1)燃烧的热化学方程式为:③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=﹣1366.8kJ/mol;
利用盖斯定律②﹣③可得:
C2H4(g)+H2O(l)=C2H5OH(l)△H=(﹣1411.0kJ/mol)﹣(﹣1366.8kJ/mol)=﹣44.2kJ/mol,
故选:A.
写出各种物质燃烧的热化学方程式,运用盖斯定律求出C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H.

【题目】25℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) | K(HClO) | K(H2CO3)a1=4.4×10﹣7 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )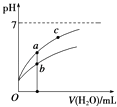
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:c(H+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)
B.图象中a、c两点所处的溶液中 ![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图象中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O=2HClO+CO32﹣
【题目】在一定体积的密闭容器中,进行如下化学反应: CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=;
(2)该反应为反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)c(H2)=5c(CO)c(H2O),试判断此时的温度为℃;
(4)830℃时,向该容器中加入1L CO2与1L H2 , 平衡时CO2的体积分数是 .



