题目内容
2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g)
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L

(1)①略(2分) ② bd (2分)
(2)CH4(g)+N2O4(g) ==N2(g) +2H2O(g) + CO2(g) △H=" —898.1kJ/mol" (3分)
(3)①CH4 —8e— + 2H2O =CO2 + 8H+ (2分)
②14 (2分) ③ 1.68L(3分)
(2)CH4(g)+N2O4(g) ==N2(g) +2H2O(g) + CO2(g) △H=" —898.1kJ/mol" (3分)
(3)①CH4 —8e— + 2H2O =CO2 + 8H+ (2分)
②14 (2分) ③ 1.68L(3分)
试题分析:
(1)①根据平衡常数公式:

②体系为绝热、恒容,说明与外界没有能量的交换。随着反应的进行,体系的热量会升高。
b、随反应进行温度升高,平衡向左移动,K值降低。
d、当NO的质量分数不变时,说明达到平衡。
(2)根据盖斯定律:CH4(g)+N2O4(g) ==N2(g) +2H2O(g) + CO2(g) △H= —898.1kJ/mol
(3)①CH4在负极是失电子变为CO2。 所以,CH4 —8e— + 2H2O =CO2 + 8H+
②第一阶段先电解HCl,后电解水。先是0.1molCl-放电,生成Cl2,而生成的H2有0.1mol,即有0.2mol的H+产生,则有后0.1mol的H+放电时是由水电离出氢氧根,刚好有0.1molOH-生成,即氢阳根浓度为1mol/L,故PH为14。
③阳极反应:Cl- - 2e- = Cl2
4OH- - 4e- = 2H2O +O2
总共转移0.2mol电子,生成0.05molCl2和0.025molO2,总体积为1.68L。

练习册系列答案
相关题目





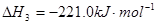
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 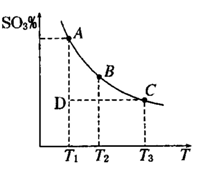
 2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
2SO3(g),混合体系中SO3 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
 (填“>”“<”或“=”)
(填“>”“<”或“=”)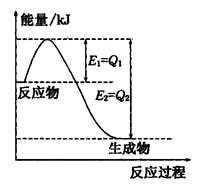
 N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 2CO2+ N2 △H
2CO2+ N2 △H


 2Fe(s)+3CO2(g),请回答下列问题:
2Fe(s)+3CO2(g),请回答下列问题: