题目内容
已知2H2(g)+O2(g) →2H2O(l)+571.6kJ,2H2(g)+O2(g) →2H2O(g)+483.6kJ。下列说法正确的是
| A.2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 |
| B.1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 |
| C.1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 |
| D.等质量的H2O (g)比H2O(l)所含能量低 |
B
试题分析:A.2 molH2(g)和1molO2(g)的总能量大于2mol H2O (l)的能量,该反应为放热反应;B.根据盖斯定律,反应的吸放热只跟始态和终态有关,和反应途径无关,1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量;C.1mol H2O (l)变成1mo1 H2O (g),吸收44kJ能量;D.等质量的H2O (g)比H2O(l)所含能量高,同一物质的气态要比液态的能量高。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
 H= ?241.8kJ/mol
H= ?241.8kJ/mol  2SO3(g);
2SO3(g); 2NO(g)
2NO(g) 
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 
 CH3OH(g);△H=-90.8kJ·mol-1
CH3OH(g);△H=-90.8kJ·mol-1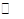 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。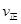 _______
_______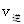 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
 O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
 (mol/L)-2
(mol/L)-2

