题目内容
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是
A.反应在前50 s 的平均速率v(PCl3)=" 0." 0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=" 0." 11 mol·L-1,则反应的△H < 0
C.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3和0. 20 mol Cl2,反应达到平衡前v(正) > v(逆)
D.相同温度下,起始时向容器中充入2. 0 mol PCl3和2. 0 mol Cl2,达到平衡时,PCl3的转化率小于80%
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A.反应在前50 s 的平均速率v(PCl3)=" 0." 0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=" 0." 11 mol·L-1,则反应的△H < 0
C.相同温度下,起始时向容器中充入1. 0 mol PCl5、0. 20 mol PCl3和0. 20 mol Cl2,反应达到平衡前v(正) > v(逆)
D.相同温度下,起始时向容器中充入2. 0 mol PCl3和2. 0 mol Cl2,达到平衡时,PCl3的转化率小于80%
C
试题分析:反应在前50 s 的平均速率v(PCl3)=
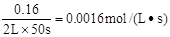 ,选项A不正确;平衡时c(PCl3)=" 0." 10 mol·L-1,若保持其他条件不变,升高温度,平衡时c(PCl3)=" 0." 11 mol·L-1,则说明升高温度,平衡向正反应方向进行,即正反应是放热反应,选项B不正确;根据平衡时c(PCl3)=" 0." 10 mol·L-1可知,平衡时PCl5和氯气的浓度分别是0.4mol/L和0.1mol/L,所以该反应的平衡常数K=
,选项A不正确;平衡时c(PCl3)=" 0." 10 mol·L-1,若保持其他条件不变,升高温度,平衡时c(PCl3)=" 0." 11 mol·L-1,则说明升高温度,平衡向正反应方向进行,即正反应是放热反应,选项B不正确;根据平衡时c(PCl3)=" 0." 10 mol·L-1可知,平衡时PCl5和氯气的浓度分别是0.4mol/L和0.1mol/L,所以该反应的平衡常数K= 。选项C中此时
。选项C中此时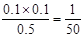 <1/40,所以反应向正反应方向进行,即反应达到平衡前v(正)>v(逆),选项C正确;2. 0 mol PCl3和2. 0 mol Cl2就相当于是2molPCl5。由于正反应是体积增大的,所以此时和原平衡相比,相当于是增大压强,平衡向逆反应方向进行,因此 PCl3的物质的量小于0.4mol,则达到平衡时,PCl3的转化率大于于80%,选项D不正确,答案选C。
<1/40,所以反应向正反应方向进行,即反应达到平衡前v(正)>v(逆),选项C正确;2. 0 mol PCl3和2. 0 mol Cl2就相当于是2molPCl5。由于正反应是体积增大的,所以此时和原平衡相比,相当于是增大压强,平衡向逆反应方向进行,因此 PCl3的物质的量小于0.4mol,则达到平衡时,PCl3的转化率大于于80%,选项D不正确,答案选C。点评:本题综合性较强,难度较大,需要用等效平衡解决问题。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
 2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
2NH3(g) △H<0。在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
 2SO3(g) ΔH<0
2SO3(g) ΔH<0
 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为 
 2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是
2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是 2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
 CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应: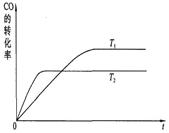
 mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )
mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间D的平均反应速率为0.1mol·L-1·min-1,以下结论正确的是 ( )