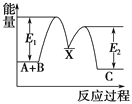
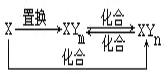
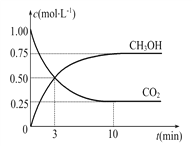
题目内容
【题目】某溶液中大量存在以下五种离子:Cl﹣、SO42﹣、Fe3+、H+、M,其物质的量浓度之比为c(Cl﹣):c(SO42﹣):c(Fe3+):c(H+):c(M)=5:3:2:3:2,则M可能是( )
A.Ag+
B.Mg2+
C.NO ![]()
D.Na+
【答案】D
【解析】解:物质的量之比为c(Cl﹣):c(SO42﹣):c(Fe3+):c(H+):c(M)=5:3:2:3:2,假设各离子的物质的量分别为5mol、3mol、2mol、3mol、2mol,则n(Cl﹣)+2×n(SO42﹣)=5mol+2×3mol=11mol,
3×n(Fe3+)+n(H+)=3×2mol+3mol=9mol,
阴离子所带电荷大于阳离子所带电荷,则M一定为阳离子,因M的物质的量为2mol,根据电荷守恒,则离子应带1个正电荷,
又因Ag+在酸性条件下与Cl﹣反应生成沉淀而不能大量共存,
故选D.
根据溶液呈电中性,从电荷守恒和离子共存的角度判断.

练习册系列答案
相关题目
【题目】下列物质的分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | Cu2(OH)2CO3 | Fe2O3 | SO3 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NaHSO4 | CaF2 | MgO | SO2 |
D | KOH | HNO3 | NaHCO3 | CaO | CO2 |
A. A B. B C. C D. D