题目内容
【题目】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0。
Fe(s)+CO2(g) ΔH>0。
已知在1100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);
②1100 ℃时测得高炉中,[CO2]=0.025 mol·L-1,[CO]=0.1 mol·L-1,则在这种情况下,该反应向______进行(填“左”或“右”),判断依据是__________________________。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,现向体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
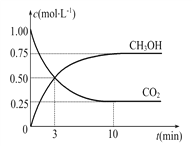
①从反应开始到平衡,氢气的平均反应速率v(H2)=____。
②反应达到平衡后,下列措施能使![]() 增大的是_____(填符号)。
增大的是_____(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g)
【答案】 增大 右 因为[CO2]/[CO]=0.25<0.263 0.225 mol·L-1·min-1 B、D
【解析】试题分析:(1)①因为炼铁反应为吸热反应,升高温度,平衡常数增大,②FeO(s)+CO(g)![]() Fe(s)+CO2(g)在1100 ℃时的平衡常数为0.263,此时Qc=c(CO2)/c(CO)="0.025" mol·L-1/0.1 mol·L-1=0.25<0.263,说明反应没有达到平衡,反应向右进行;
Fe(s)+CO2(g)在1100 ℃时的平衡常数为0.263,此时Qc=c(CO2)/c(CO)="0.025" mol·L-1/0.1 mol·L-1=0.25<0.263,说明反应没有达到平衡,反应向右进行;
(2)①根据反应过程中CO2的浓度变化可知,从反应开始到达平衡,CO2的浓度变化为0.75 mol·L-1,所以H2的浓度变化为3×0.75 mol·L-1="2.25" mol·L-1,H2的反应速率为2.25 mol·L-1/10 min="0.225" mol·L-1·min-1。②使[CH3OH]∕[CO2]增大,需要使平衡向正反应方向移动,升高温度,平衡向逆反应方向移动,A错误;再充入H2,CH3OH的浓度增大,CO2浓度减小,比值增大,B正确;再充入CO2,CO2的转化率减小,CO2浓度增大,CH3OH浓度虽然增大,但是不如CO2浓度增大的多,比值减小,C错误;将H2O(g)从体系中分离出来,平衡向右移动,CH3OH浓度增大,CO2浓度减小,比值增大,D正确;充入He对平衡无影响,比值不变,E错误,选BD。

【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2______(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是____________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_____________mol·L-1。写出该混合溶液中的下列算式的精确结果 (数据不能做近似计算,不用化简)。c(Na+)-c(A-)=____________mol·L-1 c(OH-)-c(HA)=____________mol·L-1