题目内容
6.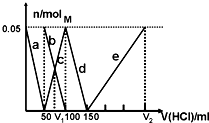 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A. | M点时生成的CO2为0mol | |
| B. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:1 | |
| C. | V1:V2=1:3 | |
| D. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
分析 Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸后,首先发生反应:AlO2-+H++H2O═Al(OH)3↓,a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
AlO2-反应完毕,发生反应:CO32-+H+═HCO3-,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
CO32-反应完毕,发生反应HCO3-+H+═CO2↑+H2O,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸150mL-100mL=50mL,根据方程式可知n(HCO3-)=n(H+);
发生反应Al(OH)3+3H+═Al3++3H2O,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,进而求出消耗盐酸的体积.
解答 解:Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,先发生的反应为:AlO2-+H++H2O═Al(OH)3↓,则a曲线表示AlO2-,由图可知AlO2-反应完毕,加入盐酸50mL,根据方程式可知:n(AlO2-)=n(H+)=0.05mol×1mol/L=0.05mol;
AlO2-反应完毕后发生反应:CO32-+H+═HCO3-,b曲线表示CO32-,c曲线表示HCO3-,由图可知CO32-反应完毕,该阶段加入盐酸体积为:100mL-50mL=50mL,根据方程式可知:n(CO32-)=n(H+)=0.05mol×1mol/L=0.05mol;
CO32-反应完后又发生反应:HCO3-+H+═CO2↑+H2O,d曲线表示HCO3-,由图可知HCO3-反应完毕,该阶段加入盐酸体积为:150mL-100mL=50mL,根据方程式可知:n(HCO3-)=n(H+)=0.05mol;
最后发生反应为:Al(OH)3+3H+═Al3++3H2O,e曲线表示Al3+,由图可知Al(OH)3反应完毕,根据方程式可知:n(H+)=3n[Al(OH)3]=3×0.05mol=0.15mol,该阶段加入盐酸体积为:$\frac{0.15mol}{1mol/L}$=0.15L=150mL;
A.根据述分析可知,M点时溶液中CO32-完全转化为HCO3-,没有CO2生成,故A正确;
B.由上述分析可知,原混合溶液中的CO32-与AlO-2的物质的量之比为:0.05mol:0.05mol=1:1,故B正确;
C.原溶液中n(CO32-)=0.05mol,V1时溶液中碳酸氢根离子等于碳酸根离子为0.025ml,由反应CO32-+H+═HCO3-可知,需要盐酸为0.025mol,盐酸的体积为25mL,故V1=50mL+25mL=75mL,由上述分析可知,V2=150mL+150mL=300mL,故V1:V2=75mL:300mL=l:4,故C错误;
D.由上述分析可知,a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓,故D正确;
故选C.
点评 本题结合图象曲线考查了有关混合物反应的计算,题目难度较大,明确离子性质及反应的先后顺序为解答关键,试题侧重考查对图象曲线的分析、理解能力及化学计算能力.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案| A. | BaCl2 Na2CO3 AgNO3 盐酸 | B. | BaCl2 Na2CO3 盐酸 AgNO3 | ||
| C. | Na2CO3 盐酸 AgNO3 BaCl2 | D. | AgNO3 盐酸 BaCl2 Na2CO3 |
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡向左移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2═Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n(HNO3(稀))═1:3 4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为:
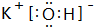 .
.(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.