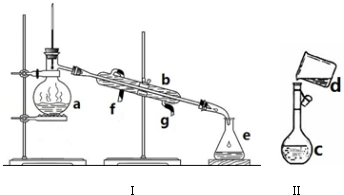
题目内容
17.漂白粉是常用的消毒剂和漂白剂.根据所学知识,回答下列问题:(1)工业上将氯气通入石灰乳制取漂白粉,化学反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)漂白粉的主要成分是(填化学式)CaCl2、Ca(ClO)2,有效成分是(化学式)Ca(ClO)2.
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
(4)将漂白粉溶于水中,呈白色浊状物,静置沉降.取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈碱性(填“酸、碱或中”),并具有漂白性.
分析 (1)氯气通入石灰乳制取漂白粉,漂白粉含氯化钙、次氯酸钙;
(2)漂白粉的主要成分是氯化钙、次氯酸钙,有效成分为次氯酸钙;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,还生成碳酸钙;
(4)漂白粉溶液水解显碱性,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,褪色说明含漂白性.
解答 解:(1)氯气通入石灰乳制取漂白粉,漂白粉含氯化钙、次氯酸钙,反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分为Ca(ClO)2,故答案为:CaCl2、Ca(ClO)2;Ca(ClO)2;
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,还生成碳酸钙,该反应为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(4)漂白粉溶液水解显碱性,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,褪色说明含漂白性,故答案为:碱;漂白.
点评 本题考查漂白粉的性质及制备,为高频考点,注意利用信息提供的反应物与生成物书写反应,侧重化学反应方程式的考查,题目难度不大.

练习册系列答案
相关题目
7.一定温度下,在体积可变的恒温密闭容器中,甲醇在浓硫酸作催化剂的条件下发生下列反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列有关该反应的叙述正确的是( )
| A. | 该条件下,1 mol CH3OH(g)参加反应,放出的热量为25 kJ | |
| B. | 若不采用合适的催化剂,该反应中甲醇的转化率将降低 | |
| C. | 升高温度和增大压强(缩小容器容积)均可加快反应速率 | |
| D. | 反应过程中,2v(CH3OH)=v(CH3OCH3) |
5.一定条件下反应2A(g)?2B(g)+C(g)△H>0达平衡后,要增大逆反应速率而使C的浓度减小,可采取的措施是( )
| A. | 加压 | B. | 增加C的浓度 | C. | 增加B的浓度 | D. | 加热 |
9.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 在16 g18O2中含有NA个氧原子 | |
| B. | 16 g CH4中含有4NA个C-H键 | |
| C. | 1 mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
6.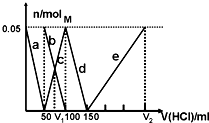 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A. | M点时生成的CO2为0mol | |
| B. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:1 | |
| C. | V1:V2=1:3 | |
| D. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
7.已知乙苯能在一定条件下发生下列过程,其中是因为苯环对侧链的影响而发生的是( )
| A. | 燃烧反应 | B. | 硝化反应 | ||
| C. | 与酸性高锰酸钾溶液作用 | D. | 加成反应 |
 甲醇是一种新型的能源.
甲醇是一种新型的能源.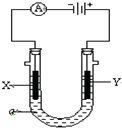 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: