题目内容
18.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ⑩ | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
第一电离能:②大于③;电负性:②小于③;非金属性:①小于⑦;离子半径:④小于⑥.
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式为:HClO4;碱性最强的化合物的电子式为:
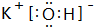 .
.(3)最高价氧化物是两性氧化物的元素是Al (填元素符号);写出其最高价氧化物与⑨的最高价氧化的水化物反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
分析 由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Be.
(1)N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
同周期随原子序数增大,电负性增大;
碳酸的酸性比较高氯酸的酸性弱,非金属性越强最高价含氧酸的酸性越强;
电子层结构相同的离子,核电荷数越大离子半径越小,而离子的电子层越多,离子半径越大;
(2)在最高价氧化物的水化物中,酸性最强的化合物为高氯酸,上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成;
(3)铝元素的最高价氧化物--氧化铝是两性氧化物,⑨的最高价氧化的水化物为KOH,氧化铝与氢氧化钾反应生成偏铝酸钾与水.
解答 解:由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Be.
(1)N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O;
同周期随原子序数增大,电负性增大,故电负性N<O;
碳酸的酸性比较高氯酸的酸性弱,非金属性越强最高价含氧酸的酸性越强,则非金属性C<Cl;
Na+离子比S2-离子少一个电子层,故离子半径:Na+<S2-,
故答案为:大于;小于;小于;小于;
(2)在最高价氧化物的水化物中,酸性最强的化合物为HClO4,上述元素中K的金属性最强,故KOH的碱性最强,由钾离子与氢氧根离子构成,电子式为: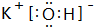 ,
,
故答案为:HClO4;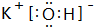 ;
;
(3)铝元素的最高价氧化物--氧化铝是两性氧化物,⑨的最高价氧化的水化物为KOH,氧化铝与氢氧化钾反应生成偏铝酸钾与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al;Al2O3+2OH-═2AlO2-+H2O.
点评 本题考查元素周期律和元素周期表的综合应用,侧重常用化学用语、元素周期律的考查,难度不大,注意基础知识的理解掌握.

| A. | 在16 g18O2中含有NA个氧原子 | |
| B. | 16 g CH4中含有4NA个C-H键 | |
| C. | 1 mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
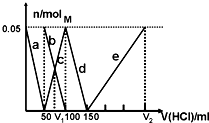 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A. | M点时生成的CO2为0mol | |
| B. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:1 | |
| C. | V1:V2=1:3 | |
| D. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
| A. | 3:1 | B. | 9:2 | C. | 2:1 | D. | 4:1 |
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙醇 |
| A. | 如果5.6LN2含有n个氮分子,则NA一定约为4n | |
| B. | 18g水中所含的电子数是8NA | |
| C. | 在100mL0.5mol/L盐酸溶液中含有氯化氢分子数为0.05 NA | |
| D. | 23g Na+含有10mol电子 |
| A. | 燃烧反应 | B. | 硝化反应 | ||
| C. | 与酸性高锰酸钾溶液作用 | D. | 加成反应 |

| A. | 图甲表示反应:4CO(g)+2NO2(g)=N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)=3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)=N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
 甲醇是一种新型的能源.
甲醇是一种新型的能源.