题目内容
16.能用H++OH-=H2O离子方程式表示的化学反应,请举出5个不同的化学方程式.分析 离子方程式H++OH-=H2O表示强酸与强碱生成可溶性盐和水的反应,如:盐酸与氢氧化钠、硫酸氢钠与氢氧化钠、硫酸与氢氧化钾、盐酸与氢氧化钙、盐酸与氢氧化钡的反应.
解答 解:强酸与强碱生成可溶性盐和水的离子反应为H++OH-=H2O,如:HCl+NaOH=NaCl+H2O、NaHSO4+NaOH=Na2SO4+H2O、H2SO4+2KOH=K2SO4+2H2O、2HCl+Ca(OH)2=CaCl2+2H2O、2HCl+Ba(OH)2=BaCl2+2H2O等,
答:能用H++OH-=H2O离子方程式表示的化学反应有HCl+NaOH=NaCl+H2O、NaHSO4+NaOH=Na2SO4+H2O、H2SO4+2KOH=K2SO4+2H2O、2HCl+Ca(OH)2=CaCl2+2H2O、2HCl+Ba(OH)2=BaCl2+2H2O.
点评 本题考查了离子方程式的意义及化学方程式的书写,题目难度中等,明确离子方程式表示的意义为解答关键,注意掌握化学方程式的书写方法.

练习册系列答案
相关题目
7.一定温度下,在体积可变的恒温密闭容器中,甲醇在浓硫酸作催化剂的条件下发生下列反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列有关该反应的叙述正确的是( )
| A. | 该条件下,1 mol CH3OH(g)参加反应,放出的热量为25 kJ | |
| B. | 若不采用合适的催化剂,该反应中甲醇的转化率将降低 | |
| C. | 升高温度和增大压强(缩小容器容积)均可加快反应速率 | |
| D. | 反应过程中,2v(CH3OH)=v(CH3OCH3) |
4.下表各组物质中,物质之间不可能实现如图所示转化的是( )
[X]$\stackrel{M}{→}$[Y]$\stackrel{M}{→}$[Z]
[X]$\stackrel{M}{→}$[Y]$\stackrel{M}{→}$[Z]
| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO | O 2 |
| A. | A | B. | B | C. | C | D. | D |
11.某化学小组用下图装置电解CuCl2溶液制少量漂白液:
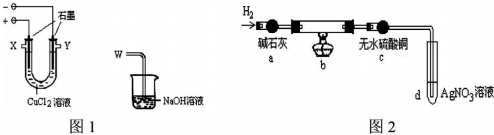
(1)图l阳极的反应式是:2Cl--2e-=Cl2↑,导气管W端应与出气口一X连接.
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.某化学兴趣小组查阅资料可知:
化学小组分析提出:
①红色物质可能有Cu或Cu2O、或二者都有;
②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
①碳棒上的红色物质是Cu,无水硫酸铜的作用是检验红色物质中有无Cu2O;
②d中反应的离子方程式是Ag++Cl-=AgCl↓;
③装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为Cu2++e-+Cl-=CuCl↓.
⑤阴极上产生白色物质的物质的量是$\frac{{w}_{1}-{w}_{2}}{35.5}$mol;若装置b冷却时不继续通H2,则计算所得CuCl的产率会偏小(偏大、偏小、不变).

(1)图l阳极的反应式是:2Cl--2e-=Cl2↑,导气管W端应与出气口一X连接.
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.某化学兴趣小组查阅资料可知:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
①红色物质可能有Cu或Cu2O、或二者都有;
②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
①碳棒上的红色物质是Cu,无水硫酸铜的作用是检验红色物质中有无Cu2O;
②d中反应的离子方程式是Ag++Cl-=AgCl↓;
③装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为Cu2++e-+Cl-=CuCl↓.
⑤阴极上产生白色物质的物质的量是$\frac{{w}_{1}-{w}_{2}}{35.5}$mol;若装置b冷却时不继续通H2,则计算所得CuCl的产率会偏小(偏大、偏小、不变).
1.光纤通讯是一种现代化的通讯手段,制造光导纤维的主要原料是( )
| A. | 单晶硅 | B. | 普通玻璃 | C. | 二氧化硅 | D. | 聚氯乙烯纤维 |
5.一定条件下反应2A(g)?2B(g)+C(g)△H>0达平衡后,要增大逆反应速率而使C的浓度减小,可采取的措施是( )
| A. | 加压 | B. | 增加C的浓度 | C. | 增加B的浓度 | D. | 加热 |
6.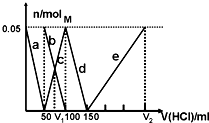 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A. | M点时生成的CO2为0mol | |
| B. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:1 | |
| C. | V1:V2=1:3 | |
| D. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
 甲醇是一种新型的能源.
甲醇是一种新型的能源.