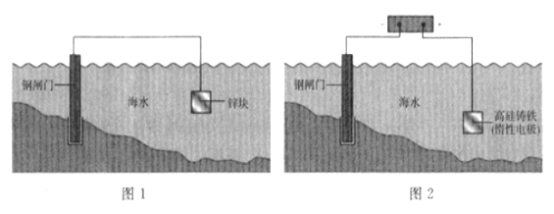
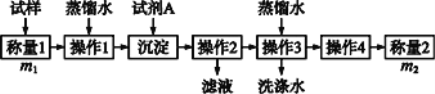
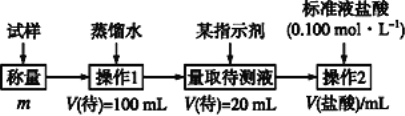
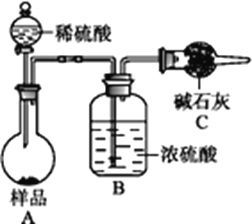
题目内容
【题目】(1)阳离子![]() 共有m个电子,则中子数N=_______。
共有m个电子,则中子数N=_______。
(2)某金属氯化物MCl240.5g,含有0.6mol Cl-,则该氯化物的摩尔质量是________。
(3)KClO2属于钾盐,其中氯元素的化合价为_______;KClO2在水溶液中完全电离,则其电离方程式为:_______。
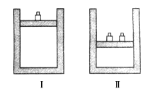
(4)写出分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体的方法_,写出从碘水中提取碘单质的方法_____。
【答案】A-m-n 135g/mol +3 KClO2=K++ ClO2 蒸馏 萃取和分液
【解析】
(1)阳离子![]() 共有m个电子,则X元素的核内含有m+n个质子,结合A=Z+N计算中子数N;
共有m个电子,则X元素的核内含有m+n个质子,结合A=Z+N计算中子数N;
(2)根据M=![]() 来计算;
来计算;
(3)根据KClO2中各元素的化合价的代数和为0,计算氯元素的化合价;KClO2在溶液中完全电离,据此书写电离方程式;
(4)酒精和甲苯二者互溶,但沸点不同;碘在水中的溶解度比在有机物中的溶解度小,据此分析解答。
(1)阳离子![]() 共有m个电子,则X元素的核内含有m+n个质子,则中子数N= A-(m+n)=A-m-n,故答案为:A-m-n;
共有m个电子,则X元素的核内含有m+n个质子,则中子数N= A-(m+n)=A-m-n,故答案为:A-m-n;
(2)含有0.6molCl-,则金属氯化物MCl2的物质的量是![]() =0.3mol,所以该氯化物的摩尔质量M=
=0.3mol,所以该氯化物的摩尔质量M=![]() =135g/mol,故答案为:135g/mol;
=135g/mol,故答案为:135g/mol;
(3)KClO2中K元素的化合价为+1,O元素的化合价为-2,设氯元素的化合价为x,则+1+x+(-2)×2=0,解得x=+3;KClO2在溶液中完全电离出钾离子和ClO2-,其电离方程式为:KClO2=K++ClO2-,故答案为:+3;KClO2=K++ClO2-;
(4)二者互溶,但沸点不同,可以利用沸点的差异来分离,即采用蒸馏法分离;碘在水中的溶解度比在有机物中的溶解度小,可以选择适当的萃取剂进行萃取,即采用萃取分液法分离,故答案为:蒸馏;萃取和分液。