题目内容
【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀性。如图所示为一种以镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)用离子方程式解释加入H2O2的作用:_________________。
(3)室温下滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。

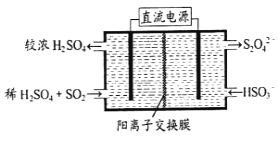
(4)电解制备镍的反应原理如上图所示,则A电极的反应式为2H++2e-=H2↑和________________________。
【答案】SiO2 2Fe2++H2O2+2H+=2Fe3++2H2O 3 7 Ni2+和Fe2+不能分离 Ni2++2e-=Ni
【解析】
将废料酸溶,废料中的Fe、Ni元素均以+2价离子的形式存在,二氧化硅不溶于稀硫酸,故滤渣1为二氧化硅,而后为了分离Fe2+、Ni2+,要先将亚铁离子氧化为+3价,而后沉淀除去,进而进行后续操作。
(1)废料中只有二氧化硅不溶于稀硫酸,故滤渣1为SiO2;
(2)加入过氧化氢,可将亚铁离子氧化为+3价,方便后续的沉淀操作,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)铁刚好沉淀完全,此时![]() ,那么
,那么![]() ,pOH=11,pH=3;Ni开始沉淀,
,pOH=11,pH=3;Ni开始沉淀,![]() ,pOH=7,则pH=7;若上述过程中没有“氧化”步骤,其后果是无法将Ni2+和Fe2+分离开;
,pOH=7,则pH=7;若上述过程中没有“氧化”步骤,其后果是无法将Ni2+和Fe2+分离开;
(4)根据电解的目的以及A电极的反应式知,A电极上发生得电子的还原反应,则A电极上还有镍离子放电,电极反应式为Ni2++2e-=Ni。

 名校课堂系列答案
名校课堂系列答案【题目】H、Al、O、N、S、Fe是常见的六种元素。
(1)S位于元素周期表______周期第______族,Fe的基态原子核外价电子排布式为______;O的基态原子核外有______种运动状态不同的电子。
(2)用“>”“<”或“=”填空
第一电离能 | 氧化性 | 沸点 | 非金属性 |
N______S | Fe3+______ Al3+ | NH3______H2O | 16O______18O |
(3)已知:下列两个热化学方程式:
4Fe(s)+302(g)=2Fe2O3(s)△H=﹣a kJ/mol
4Al(s)+3O2(g)=2Al2O3(s)△H=﹣b kJ/mol
则Al(s)的单质和Fe2O3(s)反应的热化学方程式是______。
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目____________________________。