题目内容
【题目】(1)配平氧化还原反应方程式:____________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]()
(2)称取6.0g含![]() 、
、![]() 和
和![]() 的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
的试样,加水溶解,配成250ml溶液。量取两份此溶液各25.00ml,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20.00ml时,溶液由无色变为浅红色。该溶液被中和的![]() 的总物质的量为____mol。
的总物质的量为____mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液。
A.![]() 溶液在滴定过程中作_____
溶液在滴定过程中作_____![]() 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂”![]() ,该滴定过程___
,该滴定过程___![]() 填“需要”或“不需要”
填“需要”或“不需要”![]() 另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
另加指示剂。滴至16.00ml时反应完全,此时溶液颜色由____变为_____。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
C.若在达到滴定终点时俯视读数,则所得结果_____![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
③原试样中![]() 的质量分数为______,
的质量分数为______,![]() 的质量分数为_____。
的质量分数为_____。
【答案】![]() 、2、16、10、2、8
、2、16、10、2、8 ![]() 氧化剂 不需要 无色 浅紫红色 无影响 偏小
氧化剂 不需要 无色 浅紫红色 无影响 偏小 ![]()
![]()
【解析】
(1)C元素的化合价由![]() 价升高为
价升高为![]() 价,Mn元素的化合价由
价,Mn元素的化合价由![]() 价降低为
价降低为![]() 价,利用守恒法可写出离子方程式。
价,利用守恒法可写出离子方程式。
(2)①溶液由无色变为浅红色,溶液中![]() 、
、![]() 完全反应,消耗NaOH的物质的量
完全反应,消耗NaOH的物质的量![]() ,结合反应本质
,结合反应本质![]() ,可求出被中和的
,可求出被中和的![]() 的物质的量。
的物质的量。
②A.根据![]() 中的反应方程式可知,锰元素化合价降低,所以在滴定过程中,
中的反应方程式可知,锰元素化合价降低,所以在滴定过程中,![]() 溶液在滴定过程中作氧化剂,由于高锰酸钾溶液本身呈紫红色,产物接近无色,所以不需另加指示剂。
溶液在滴定过程中作氧化剂,由于高锰酸钾溶液本身呈紫红色,产物接近无色,所以不需另加指示剂。
B.接近终点时,用少量蒸馏水将锥形瓶冲洗一下,不影响反应物的物质的量。
C.若在达到滴定终点时俯视读数,所读取的高锰酸钾溶液的体积偏小。
③设C2O42-的物质的量为n
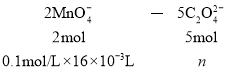
![]()
令25mL溶液中![]() 、
、![]() 的物质的量分别为xmol、ymol,发生反应:
的物质的量分别为xmol、ymol,发生反应:
![]()
![]()
由题意可知:![]() ,
,
解得![]() ,
,![]() ,
,
由此可求出原样品中![]() 的质量分数和
的质量分数和![]() 的质量分数。
的质量分数。
(1)C元素的化合价由![]() 价升高为
价升高为![]() 价,Mn元素的化合价由
价,Mn元素的化合价由![]() 价降低为
价降低为![]() 价,则离子反应为
价,则离子反应为![]() ,故答案为:
,故答案为:![]() 、2、16、10、2、8;
、2、16、10、2、8;
(2)①溶液由无色变为浅红色,溶液中![]() 、
、![]() 完全反应,消耗NaOH的物质的量
完全反应,消耗NaOH的物质的量![]() ,结合反应本质
,结合反应本质![]() ,可知被中和的
,可知被中和的![]() 的物质的量
的物质的量![]() ,故答案为:
,故答案为:![]() ;
;
②A.根据![]() 中的反应方程式可知,锰元素化合价降低,所以在滴定过程中,
中的反应方程式可知,锰元素化合价降低,所以在滴定过程中,![]() 溶液在滴定过程中作氧化剂,由于高锰酸钾溶液本身呈紫红色,所以可以根据溶液颜色由无色变为紫红色,判断滴定终点,所以不需要另加指示剂,当反应完全时,溶液颜色由无色变为浅紫红色,故答案为:氧化剂;不需要;无色;浅紫红色;
溶液在滴定过程中作氧化剂,由于高锰酸钾溶液本身呈紫红色,所以可以根据溶液颜色由无色变为紫红色,判断滴定终点,所以不需要另加指示剂,当反应完全时,溶液颜色由无色变为浅紫红色,故答案为:氧化剂;不需要;无色;浅紫红色;
B.接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,对实验没有影响,故答案为:无影响;
C.若在达到滴定终点时俯视读数,所读取的高锰酸钾溶液的体积偏小,所以所得结果偏小。答案为:偏小;
③设C2O42-的物质的量为n
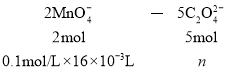
![]()
令25mL溶液中![]() 、
、![]() 的物质的量分别为xmol、ymol,发生反应:
的物质的量分别为xmol、ymol,发生反应: ![]()
![]() /p>
/p>
由题意可知:![]() ,
,
解得![]() ,
,![]() ,故原样品中
,故原样品中![]() 的质量分数
的质量分数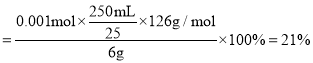 ,
,![]() 的质量分数
的质量分数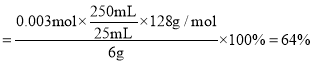 ,故答案为:
,故答案为:![]() ;
;![]() 。
。

【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀性。如图所示为一种以镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)用离子方程式解释加入H2O2的作用:_________________。
(3)室温下滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。

(4)电解制备镍的反应原理如上图所示,则A电极的反应式为2H++2e-=H2↑和________________________。