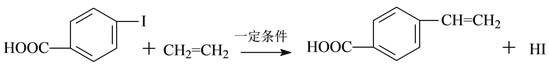题目内容
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是

A. a点时溶液中阳离子仅为Cu2+和Fe2+
B. b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C. c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D. 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
【答案】BC
【解析】A项,向100mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,先发生反应:Fe+2Fe3+=3Fe2+,后发生反应:Fe+Cu2+=Cu+Fe2+,如图加入0.56g(即0.01mol)Fe之后开始出现固体,则a点溶液中阳离子为Cu2+、Fe2+和Fe3+,故A错误;B项,由图可得,加入铁粉从0.56g~1.68g(即0.02mol)时,剩余物为1.28g,而1.28gCu的物质的量为0.02mol,所以此时发生反应为:Fe+Cu2+=Cu+Fe2+,b点在该范围内,故B正确;C项,加入铁粉为从0.56g~2.24g(即0.03mol)时,若发生反应Fe+Cu2+=Cu+Fe2+,则生成0.03mol(即1.92g)Cu,而由图示可得剩余物为1.84g,所以此时溶液中早已没有Cu2+,设0.03mol铁粉中与Cu2+反应的为x mol,剩余y mol,则生成Cu的质量为64x g,剩余铁的质量为56y g,所以x+y=0.03、64x+56y=1.84,解得:x=0.02(mol)、y=0.01(mol),因此加入铁粉从0.56g~1.68g(即0.02mol)时,刚好与溶液中的Cu2+反应完全,溶液中溶质为FeSO4,又根据前面的分析可得反应Fe+2Fe3+=3Fe2+生成Fe2+0.03mol,又因为反应Fe+Cu2+=Cu+Fe2+生成Fe2+0.02mol,所以c点时溶液中溶质的物质的量浓度为:(0.03mol+0.02mol)÷0.1L=0.5 mol·L-1,故C正确;D项,由前面的分析可得,原溶液中Fe3+为0.02mol,则Fe2(SO4)3为0.01mol,Cu2+为0.02mol,则CuSO4为0.02mol,所以原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比=物质的量之比,为1:2,故D错误。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案