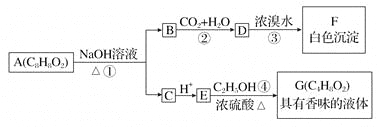
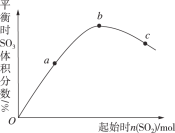
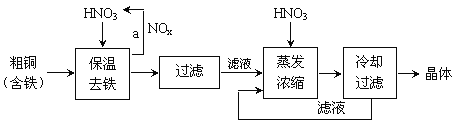
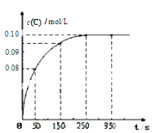
��Ŀ����
����Ŀ����֪H2S��CO2�ڸ����·�����Ӧ��H2S(g)+CO2(g)COS(g)+H2O(g)��H����Q kJmol��1 (Q��0)�����¶�ΪT1ʱ����0.10molCO2��0.40mol H2S����2.5L �Ŀո�ƿ�У�����4min��Ӧ�ﵽƽ�⣬ƽ��ʱH2O(g)�����ʵ�������Ϊ 2%��������˵������ȷ����( )
A.0��4 min����H2S��ʾ�÷�Ӧ������Ϊ0.001 molL��1min��1
B.CO2��ƽ��ת��������2.5%
C.���������·�Ӧ�ﵽƽ��ʱ�ų�������Ϊ0.01Q kJ
D.�����������䣬���÷�Ӧ���¶�ΪT2 �����½��У��ﵽƽ������ʱ��С��4 min���� T1��T2
���𰸡�B
��������
���ݷ�Ӧ�С�����ʽ����
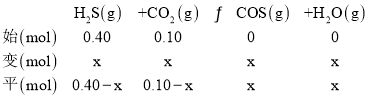
��Ӧƽ���ˮ�����ʵ�������Ϊ0.02����![]() ��0.02��x��0.01��
��0.02��x��0.01��
A��0��4 min ���� H2S ��ʾ�÷�Ӧ�����ʣ�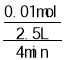 ��0.001 molL��1min��1����A��ȷ��
��0.001 molL��1min��1����A��ȷ��
B��CO2��ƽ��ת���� ����![]() ��100%��10%����B����
��100%��10%����B����
C��H2S(g)+CO2(g)COS(g)+H2O(g)��H����Q kJmol��1�����������·�Ӧ�ﵽƽ��ʱ����0.01molH2S���ų�������Ϊ0.01Q kJ����C��ȷ��
D�������������䣬���÷�Ӧ���¶�ΪT2�����½��У��ﵽƽ������ʱ��С��4min��˵�������˴ﵽƽ���ʱ�䣬�¶ȸ�����˷�Ӧ���ʣ��� T1��T2����D��ȷ��
��ѡ��B��

 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�����Ŀ����һ���2L���ܱ������м��뷴Ӧ��N2��H2���������·�Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����Ӧ�����еIJ����������±���ʾ������˵����ȷ����
2NH3(g)����Ӧ�����еIJ����������±���ʾ������˵����ȷ����
���ʵ���/ mol ʱ��/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0��2 min�ڣ�NH3�ķ�Ӧ����Ϊ0.1 mol��L��1��min��1
B. 2 minʱ�� H2�����ʵ���0.3 mol
C. 4 minʱ����Ӧ�Ѵﵽƽ��״̬����ʱ�����淴Ӧ�����ʶ�Ϊ0
D. 4��6 min�ڣ�������������ӵ������ʵ�������
����Ŀ����ˮ�к��зḻ��þ��Դ��ijͬѧ����˴�ģ�⺣ˮ���Ʊ�MgO��ʵ�鷽����

ģ�⺣ˮ�е�����Ũ��/mol��L��1 | Na�� | Mg2�� | Ca2�� | Cl�� | HCO3�� |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
ע����Һ��ij�����ӵ�Ũ��С��1.0��10��5 mol��L��1������Ϊ�����Ӳ����ڣ�ʵ������У�������Һ������䡣Ksp[CaCO3]��4.96��10��9��Ksp[MgCO3]��6.82��10��6��Ksp[Ca(OH)2]��4.68��10��6��Ksp[Mg(OH)2]��5.61��10��12������˵����ȷ���ǣ� ��
A.������XΪCaCO3
B.��ҺM�д���Mg2����������Ca2��
C.��ҺN�д���Mg2����Ca2��
D.�����������Ϊ����4.2 g NaOH���壬������YΪCa(OH)2��Mg(OH)2�Ļ����