题目内容
将AgCl分别投入下列溶液中:
①20ml 0.1mol/L的(NH4)2CO3溶液
②40ml 0.03mol/L的HCl溶液
③50ml 0.03mol/L的AgNO3溶液
④30ml 0.02mol/L的CaCl2溶液
⑤10ml 蒸馏水
⑥30ml 0.2mol/L的NH4NO3溶液
AgCl的溶解度由大到小的顺序是————
①20ml 0.1mol/L的(NH4)2CO3溶液
②40ml 0.03mol/L的HCl溶液
③50ml 0.03mol/L的AgNO3溶液
④30ml 0.02mol/L的CaCl2溶液
⑤10ml 蒸馏水
⑥30ml 0.2mol/L的NH4NO3溶液
AgCl的溶解度由大到小的顺序是————
①>⑥>⑤>②=③>④
在水中AgCl存在溶解平衡(注:第一个方程式是双向箭头)
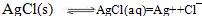
(注:s表示为溶解的固体,aq表示已被溶解,但未电离的AgCl)
当溶液中存在Ag+或者
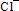 时,溶解平衡逆向移动,AgCl的溶解度减小。溶液中Ag+和
时,溶解平衡逆向移动,AgCl的溶解度减小。溶液中Ag+和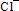 的浓度越大,逆向移动的程度越大,溶解度就越小。
的浓度越大,逆向移动的程度越大,溶解度就越小。以中性的水为参照,溶解度5>2="3>4"
又由于有反应:(注:双向)
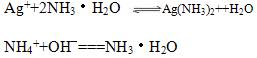
说明溶液碱性越强,NH4(+)的浓度越大,银离子越容易被消耗,AgCl的溶解度也越大。由于作为弱酸弱碱盐的(NH4)2CO3的PH值显然大于强酸弱碱盐的NH4NO3,所以与水比较有1>6>5
综上所述:1>6>5>2=3>4

练习册系列答案
相关题目