题目内容
| A.澄清石灰水中加入盐酸:Ca(OH)2+2H+==2H2O+Ca2+ |
| B.硫酸氢钠溶液中逐滴加入氧氧化钡溶液,至溶液恰好呈中性: Ba2++OH-+SO42-+H+==BaSO4↓+H2O |
| C.少量Cl2加入FeBr2溶液中:2Fe2+ +Cl2==2Fe3++2Cl- |
| D.向AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
C
澄清石灰水中Ca(OH)2完全电离,Ca(OH)2应写成离子,A错;混合后溶液恰好中性,H+离子与OH-恰好反应,NaHSO4与Ba(OH)2的物质的量之比为2:1,B错;Fe2+离子的还原性大于Br-,FeBr2中加入少量Cl2,首先氧化Fe2+,C正确;Al(OH)3不能与氨水反应,即不能Al3+与氨水反应不能生成AlO2-,D错。

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目
 Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( )
Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( ) Pb2+(aq)+2I-(aq),下列描述正确的是 ( )
Pb2+(aq)+2I-(aq),下列描述正确的是 ( )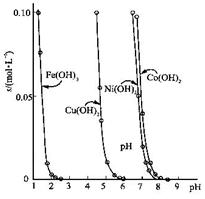
 加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。
加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式。 