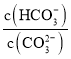题目内容
【题目】将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。
xC(g)+2D(g),5 min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是0.15 mol/(L·min)。
(1)B的反应速率v(B)=___,x=___。
(2)A在5 min末的浓度是_______。
(3)此时容器内的压强与开始时之比为:___。
【答案】0.05 mol/(L·min) 3 0.5 mol/L 11:10
【解析】
根据5 min后测得c(D)=0.5 mol/L可计算反应产生D的物质的量n(D)=0.5 mol/L×2 L=1 mol,假设反应开始时A、B的物质的量分别是n,然后根据物质反应转化关系可计算出5 min后A、B的物质的量,然后根据气体的物质的量的比等于浓度比,利用c(A):c(B)=1:2,计算x的值,再结合速率的概念及速率与浓度关系、阿伏伽德罗定律分析解答。
反应从正反应方向开始,因此起始时D的物质的量为0,5 min后测得c(D)=0.5 mol/L则此时反应产生D的物质的量n(D)=0.5 mol/L×2 L=1 mol,根据方程式可知:每反应消耗3 mol A、1 mol B就会产生2 mol D,则产生1 mol D就会消耗1.5 mol A和0.5 mol B,反应开始时A、B的物质的量相等,假设都是n mol,则5 min时n(A)=(n-1.5)mol,n(B)=(n-0.5)mol,容器的容积固体不变,所以![]() ,解得n=2.5 mol。
,解得n=2.5 mol。
(1)B的反应速率v(B)= =0.05 mol/(L·min);到5 min时C的反应速率是0.15 mol/(L·min),v(B):v(C)=1:x=0.05 mol/(L·min):0.15 mol/(L·min)=1:3,所以x=3。
=0.05 mol/(L·min);到5 min时C的反应速率是0.15 mol/(L·min),v(B):v(C)=1:x=0.05 mol/(L·min):0.15 mol/(L·min)=1:3,所以x=3。
(2)A在5 min时的浓度为c(A)=![]() =0.5 mol/L;
=0.5 mol/L;
(3)根据阿伏伽德罗定律:在同温同体积时,气体的压强之比等于气体的物质的量的比,反应开始时气体的物质的量为2.5 mol+2.5 mol=5.0 mol,当进行到5 min时,气体的物质的量n(A)=(2.5-1.5)mol=1 mol,n(B)=(2.5-0.5)mol=2 mol,n(C)= 0.15 mol/(L·min)×5 min×2 L=1.5 mol,n(D)=1 mol,所以n(总)=n(A)+n(B)+n(C)+n(D)=1 mol+2 mol+1.5 mol+1 mol=5.5 mol,故此时容器内的压强与开始时之比为p2:p1=n(总):n(始)= 5.5 mol:5 mol=11:10。