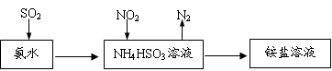题目内容
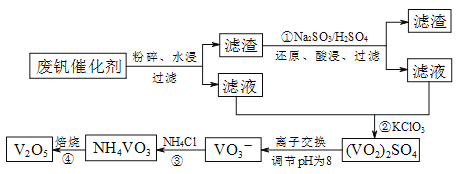
【题目】为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)图中所示滤液中含钒的主要成分为 (写化学式)。
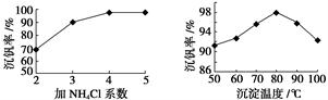
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 和 。
(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:□VO2++□H2C2O4+□________=□VO2++□CO2↑+□H2O
(4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2+ + V2+ + 2H+ ![]() VO2+ + H2O + V3+,电池放电时正极的电极反应式为 。
VO2+ + H2O + V3+,电池放电时正极的电极反应式为 。
【答案】(1)VOSO4
(2)NH4++VO3-=NH4VO3↓ ;4 ;80℃ ;
(3)2VO2++H2C2O4+2H+ = 2VO2++2CO2↑+2H2O VO2++2H+ + e- = VO2++H2O
【解析】
试题分析:
(1)根据溶解性表知,滤渣是V2O5,酸性条件下,V2O5和亚硫酸钠发生氧化还原反应生成VOSO4,图中所示滤液中含钒的主要成分为VOSO4;
(2)反应是复分解反应,反应的离子方程式是NH4++VO3-=NH4VO3↓。根据下图判断最佳控制氯化铵系数和温度为4和80℃沉钒率最大。
(3)根据化合价升降,反应的离子方程式为:2VO2++H2C2O4+2H+ = 2VO2++2CO2↑+2H2O
(4)①原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。根据总的方程式可知VO2+得到电子被还原为VO2+,因此正极电极反应式是VO2++2H++e-=VO2++H2O。