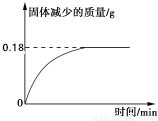
题目内容
3.化学反应方程式是化学学习的基本工具,本期在化学反应与化学平衡章节学过几个重要的化学方程式,请你按要求写出:(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:S2O32-+2H+=S↓+SO2↑+H2O
(2)碘化钾的稀硫酸溶液与空气中氧气反应的离子方程式:4I-+O2+4H+=2I2+2H2O
(3)在重铬酸钾的硫酸溶液中的Cr2O72-与CrO42-之间转化的离子方程式:Cr2O72-+H2O=2CrO42-+2H+.
分析 (1)发生氧化还原反应生成S、二氧化硫和硫酸钠、水;
(2)发生氧化还原反应生成硫酸钾、碘、水;
(3)Cr2O72-与CrO42-之间转化,遵循原子及电荷守恒.
解答 解:(1)发生氧化还原反应生成S、二氧化硫和硫酸钠、水,离子反应为S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O;
(2)发生氧化还原反应生成硫酸钾、碘、水,离子反应为4I-+O2+4 H+=2I2+2H2O,故答案为:4I-+O2+4 H+=2I2+2H2O;
(3)Cr2O72-与CrO42-之间转化,遵循原子及电荷守恒,转化的离子反应为Cr2O72-+H2O=2CrO42-+2H+,故答案为:Cr2O72-+H2O=2CrO42-+2H+.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
11.下列溶液中H+的物质的量浓度最大的是( )
| A. | 0.1mol/L的硫酸 | B. | 0.1mol/L的硝酸 | ||
| C. | 0.1mol/L的盐酸 | D. | 0.1mol/L的醋酸(CH3COOH) |
6. 溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
(1)写出制取溴苯的化学方程式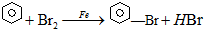 .
.
(2)仪器a的名称为三颈烧瓶,仪器c的作用是冷凝回流、导气.
(3)反应置于70-80℃水浴中而非直接加热的目的是使反应受热均匀,尽可能减少反应的挥发,防止生成的溴苯挥发.
(4)水洗后用5%氢氧化钠溶液洗涤的目的Br2+2OH-=Br-+BrO-+H2O(用离子方程式表示).
 溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.
溴苯,无色油状液体,具有苯的气味.不溶于水,能溶于有机溶剂.实验室制取溴苯时先将铁粉和苯加入反应器,在搅拌下慢慢加入溴苯,置于70-80℃水浴中反应1h,所得粗品用水及5%氢氧化钠溶液洗涤,静置分层,蒸馏;干燥;过滤,最后经常压分馏,取156-157℃馏分而得成品.制取装置如图所示,请依据下列信息回答问题.| 物质 | 溴 | 苯 | 溴苯 |
| 沸点 | 58.5℃ | 80.1℃ | 156.2℃ |
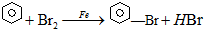 .
.(2)仪器a的名称为三颈烧瓶,仪器c的作用是冷凝回流、导气.
(3)反应置于70-80℃水浴中而非直接加热的目的是使反应受热均匀,尽可能减少反应的挥发,防止生成的溴苯挥发.
(4)水洗后用5%氢氧化钠溶液洗涤的目的Br2+2OH-=Br-+BrO-+H2O(用离子方程式表示).
4. 实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
①NaClO溶液中加入适量稀盐酸和足量KI固体时发生反应的离子方程式为ClO-+2I-+2H+═Cl-+I2+H2O.
②NaClO溶液的物质的量浓度是0.1060 mol•L -1.
 实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.
实验室需配制0.2000mol•L -1Na2S2O3标准溶液450mL,并利用该溶液对某浓度的NaClO溶液进行标定.(1)若用Na2S2O3固体来配制标准溶液,在如图所示的仪器中,不必要用到的仪器是AB(填字母),还缺少的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)根据计算需用天平称取Na2S2O3固体的质量是15.8g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度=(填“>”“<”或“=”,下同)0.2000mol•L-1.若还未等溶液冷却就定容了,则所得溶液浓度>0.2000mol•L-1.
(3)用滴定法标定的具体方法:量取20.00mL NaClO溶液于锥形瓶中,加入适量稀盐酸和足量KI固体,用0.2000mol•L -1 Na2S2O3标准溶液滴定至终点(淀粉溶液作指示剂),四次平行实验测定的V(Na2S2O3)数据如下:
(已知:I2+2Na2S2O3═2NaI+Na2S4O6)
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V(Na2S2O3)/mL | 21.90 | 18.80 | 22.10 | 22.00 |
②NaClO溶液的物质的量浓度是0.1060 mol•L -1.