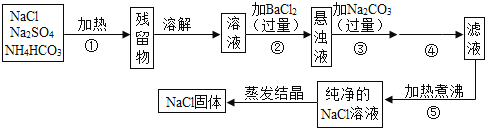
题目内容
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:
①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
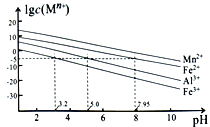
③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为________。
(2)“氧化”时,发生反应的离子方程式为_________________________。若省略“氧化”步骤,造成的后果是_________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“系列操作”指___________、过滤、洗涤、干燥。
【答案】产生硫化氢等气体,污染环境 MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O Fe2+与Mn2+沉淀区有重叠,造成Mn2+损失 Fe(OH)3、Al(OH)3 8×10-3 mol·L-1 蒸发浓缩、冷却结晶
【解析】
高硫锰矿中含硫量较高,有一部分硫以-2价的S2-形式存在,所以加硫酸酸浸时会生成硫化氢气体;依据题给的焙烧后的烧渣成分,一一分析各步的分离与除杂。将离子浓度10-5mol·L-1代入Ksp的表达式,计算出F-的最小浓度。
(1)传统工艺采用硫酸浸出,此时MnS或FeS发生复分解反应生成H2S气体,污染环境,造成浪费;
(2)“氧化”时加入的是二氧化锰是氧化剂,还原剂是Fe2+,所以发生反应的离子方程式为:MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O;将Fe2+氧化为Fe3+,在Mn2+尚未开始沉淀时,Fe3+已沉淀完全,若不氧化,则Fe2+与Mn2+沉淀的pH范围有重叠,沉淀法除Fe2+时会造成Mn2+损失;
(3)加入碳酸钙进行中和除杂时,生成的沉淀为Fe(OH)3、Al(OH)3;
(4)根据氟化钙和氟化镁的Ksp可分别计算出钙镁离子完全沉淀时氟离子的浓度,由Ksp(MgF2)=c(Ca2+)c(F-)2,求得钙离子完全沉淀时c(F-)=6×10-4mol·L-1,同理求得镁离子完全沉淀时c(F-)=8×10-3mol·L-1,当氟离子的浓度能使钙离子完全沉淀时,镁离子并没有完全沉淀,所以若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于能使镁离子完全沉淀的浓度,即不低于8×10-3mol·L-1,注意不要忘写单位;
(5)“系列操作”实现了从溶液中获得MnSO4·4H2O,因为后有“过滤、洗涤、干燥”,所以前面必有结晶。由于绝大多数固体的溶解度随温度降低而降低,所以选择降温(冷却)结晶。在结晶前应先蒸发浓缩,使溶液在较高温度下形成饱和溶液或过饱和溶液。所以本题的答案为“蒸发浓缩、冷却结晶”。