题目内容
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫________;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:CO2和CO的体积之比是________。
(5)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度分别是________
(6)现有以下物质:①NaCl晶体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧浓H2SO4 ⑨KOH固体;以上物质中属于电解质的是________
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合的离子方程式: 。
【答案】丁达尔效应; 95g/mol; N2 或者 CO或C2H4; 1∶7 ;
11.8 mol·L-1 ;①③④⑨; HCO3―+OH―+Ca2+=CaCO3↓+H2O
【解析】
试题分析:(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫丁达尔效应;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,则n(ACl2)= 0.2mol,求M(ACl2)=![]() 95g/mol
95g/mol
(3)在标准状况下,测得4.2g气体A的体积是3360mL,![]() ,M=28 g/mol,则A可能是N2 或者 CO或C2H4;
,M=28 g/mol,则A可能是N2 或者 CO或C2H4;
(4)设CO的物质的量是x,CO2的物质的量是y,![]() ,在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则x:y=1:7,CO2和CO的体积之比是1∶7。
,在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则x:y=1:7,CO2和CO的体积之比是1∶7。
(5)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度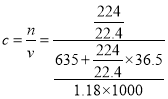 =11.8 mol·L-1
=11.8 mol·L-1
(6)在水溶液或熔融状态下能导电的化合物是电解质,以上物质中属于电解质的是①NaCl晶体、③CaCO3固体、④熔融KCl 、⑨KOH固体;
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合的离子方程式:HCO3―+OH―+Ca2+=CaCO3↓+H2O。