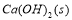题目内容
下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
C.升高温度,AgCl的溶解度增大,Ksp增大
D.FeCl3 、KAl(SO4)2、Na2CO3的水溶液均显酸性
C
【解析】
试题解析:A、溶液的导电能力与离子浓度、离子所带电荷的多少有关,与电解质的强弱无关,错误;B、一定条件下的可逆反应到达化学平衡时是指各物质的浓度保持恒定的状态,错误;C、溶解反应是吸热反应,当温度升高时,溶解平衡正向移动,离子浓度增大,平衡常数增大,正确;D、Na2CO3的水溶液显碱性,错误,答案选C。
考点:考查溶液的导电能力、平衡标志的判断、平衡常数的变化、及盐溶液的酸碱性

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目