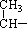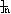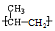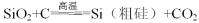题目内容
由化学能转化的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是
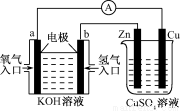
A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e- = 2H2O
D.该装置中a极为正极,发生氧化反应
D
【解析】
试题分析:由装置图可知:a电极为正极,电极反应为O2+4e-+2H2O=4OH-。发生还原反应。b电极为负极,电极反应为H2-2e-+2OH-=H2O。Cu为阳极,电极反应为:2Cu-4e-=2Cu2+.Zn为阴极。在阴极上发生反应:4OH--4e-= O2↑+2H2O。每转移4mol的电子,在a电极反应消耗氧气在标准状况下的体积为22.4L,在Cu电极上减少质量为128g.所以当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L。此时电子转移0.4mol。故错误的选项为D。
考点:考查原电池、电解池中的反应原理及电子转移和相关物质的质量或体积等的变化的知识。

 阅读快车系列答案
阅读快车系列答案氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
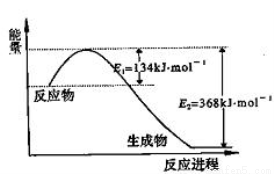
(1)上图是1 mol NO2气体和1 mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
已知:N2 (g)+2NO2 (g)  4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1,
则反应: 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H= ;
N2(g)+2CO2(g) 的△H= ;
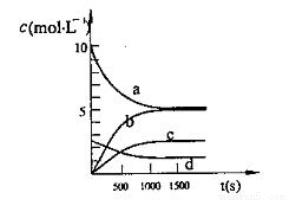
(2)一定温度下,在体积为2L的恒容密闭容器中充入20 mol NO2和5 mol O2发生反应: 4NO2(g)+O2(g) 2N2O5(g);已知体系中n(NO2)随时间变化如下表:
2N2O5(g);已知体系中n(NO2)随时间变化如下表:
t(s) | 0 | 500 | 1000 | 1500 |
n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K= ,已知:K3000C>K3500C,则该反应是 反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为 ,若要增大NO2的转化率,可采取的措施有
A.降低温度
B.充入氦气,使体系压强增大
C.再充入NO2
D.再充入4 mol NO2和1 mol O2
③图中表示N2O5的浓度的变化曲线是 ,用O2表示从0~500s内该反应的平均速率v= 。