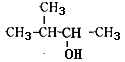题目内容
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
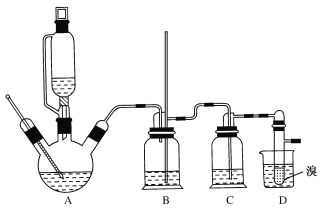
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
【答案】防暴沸 减少副产物乙醚生成 B中水面会下降,玻璃管中的水柱会上升,甚至溢出 除去乙烯中带出的酸性气体(或答除去CO2、SO2) D中试管的溴全部褪色 下 氢氧化钠溶液 蒸馏 1,2—二溴乙烷的熔点为9℃(高于冰水的温度),过度冷却会使其凝固而使导管堵塞 66.7%
【解析】
由实验装置可知,烧瓶中加碎瓷片(或沸石),可防暴沸,A中浓硫酸、乙醇加热至170℃发生消去反应生成乙烯,在140℃时易发生副反应生成乙醚,装置发生堵塞时,B中压强会逐渐增大会导致液面高度发生变化,C中NaOH可除去酸性气体,D中乙烯与溴水发生加成反应生成1,2—二溴乙烷;1,2—二溴乙烷的密度大于水,与水分层后有机层在下层,有机产物中含杂质乙醚,混合物沸点不同,可蒸馏分离,根据表中1,2-二溴乙烷的熔点信息可解答,产率=![]() ×100%,以此来解答。
×100%,以此来解答。
(1)在装置A中除了浓硫酸和乙醇外,还应加入碎瓷片(或沸石),其目的是防暴沸,在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;
答案为防暴沸,减少副产物乙醚生成。
(2)根据大气压强原理,装置发生堵塞时,B中压强会逐渐增大会导致B中水面下降,玻璃管中的水柱上升,甚至溢出;
答案为B中水面会下降,玻璃管中的水柱会上升,甚至溢出。
(3)氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应,防止杂质气体与溴反应;
答案为除去乙烯中带出的酸性气体(或答除去CO2、SO2)。
(4)D中试管发生反应CH2=CH2+Br2→CH2BrCH2Br,溴的颜色逐渐变浅,当D中试管的溴全部褪色时,表明该制备反应已经结束;
答案为D中试管的溴全部褪色。
(5)1,2—二溴乙烷的密度为2.2 gcm-3,其密度大于水,将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物会在下层;若产物中有少量未反应的Br2,选碱性溶液除去,且不引入新杂质,即氢氧化钠溶液洗涤合适,氢氧化钠与溴反应后与1,2—二溴乙烷分层,分液可分离;由表格中数据可知,乙醚与1,2—二溴乙烷的沸点差异较大,则若产物中有少量副产物乙醚,可用蒸馏的方法除去。
答案为下,氢氧化钠溶液,蒸馏。
(6)冷却可避免溴的大量挥发,但1,2—二溴乙烷的熔点为9℃(高于冰水的温度),过度冷却会使其凝固而使导管堵塞,故不能过度冷却(如用冰水);
故答案为:1,2—二溴乙烷的熔点为9℃(高于冰水的温度),过度冷却会使其凝固而使导管堵塞;
(7)根据反应方程式CH2=CH2+Br2→BrCH2CH2Br可知,12.0g的溴和足量的乙醇制备1,2—二溴乙烷的质量为12.0g×![]() =14.1g,所以产率=
=14.1g,所以产率=![]() ×100%=
×100%=![]() ×100%=66.7%;
×100%=66.7%;
答案为66.7%。

【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30mL1.0molL-1H3PO4和3mL30%H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30mL1.0molL-1H3PO4和3mLH2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85%H3PO4配制100mL1.0mol·L-1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)请结合实验Ⅱ中现象,分析铁钉与H3PO4反应的产物_______。
(3)探究实验Ⅰ中停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是未排除O2的干扰,请解释O2是如何干扰实验的:_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。形成氧化膜(以Fe3O4计)的离子方程式是____。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率角度分析其原因:______。
【题目】下列实验中,对应的操作、现象及实验原理或结论均正确的是
实验目的 | 操作和现象 | 实验原理或结论 | |
A | 验证AgI和 AgCl的 Ksp大小 | 向1mL 1mol·L-1NaCl溶液中滴加2滴 2mol·L-1 AgNO3溶液,生成白色沉淀;再滴加 2滴1mol·L-1KI溶液,白色沉淀变成黄色沉淀 | AgCl(s)+I-(aq) |
B | 比较HClO和 HF溶液的酸性 | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO 溶液、0.1mol·L-1NaF 溶液的pH | 酸越弱,酸根离子水解程度越大,其盐溶液碱性越强 |
C | 提纯混有少量硝酸钾的氯化钠固体 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升髙显著增大 |
D | 检验某溶液中是否含有CO32- | 先滴加盐酸产生气泡,将该气体通入澄清石灰水中,有白色沉淀生成 | 该溶液中一定含有CO32- |
A. AB. BC. CD. D