题目内容
【题目】钻钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有![]() 、CoS和
、CoS和![]() )中回收钴和钼的工艺流程如图:
)中回收钴和钼的工艺流程如图:
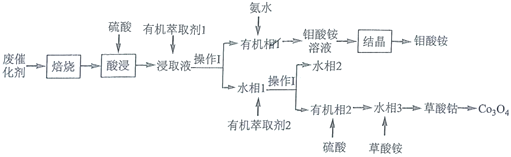
已知:浸取液中的金属离子主要为![]() 、
、![]() 、
、![]() 。
。
(1)钼酸铵![]() 中
中![]() 的化合价为________,
的化合价为________,![]() 在空气中高温焙烧产生两种氧化物:
在空气中高温焙烧产生两种氧化物:![]() 和________(填化学式)。
和________(填化学式)。
(2)为了加快酸浸速率,可采取的措施为________(任写一条)。
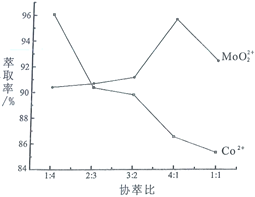
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取![]() 和
和![]() ,萃取情况如图所示,当协萃比
,萃取情况如图所示,当协萃比![]() ________,更有利于
________,更有利于![]() 的萃取。
的萃取。
(4)操作Ⅰ的名称为________。
(5)向有机相1中滴加氨水,发生的离子方程式为________。
(6)![]() 萃取的反应原理为
萃取的反应原理为![]() ,向有机相2中加入
,向有机相2中加入![]() 能进行反萃取的原因是________(结合平衡移动原理解释)。
能进行反萃取的原因是________(结合平衡移动原理解释)。
(7)水相2中的主要溶质除了![]() ,还有________(填化学式)。
,还有________(填化学式)。
(8)![]() 可用作电极,若选用
可用作电极,若选用![]() 电解质溶液,通电时可转化为
电解质溶液,通电时可转化为![]() ,其电极反应式为________。
,其电极反应式为________。
【答案】![]()
![]() 搅拌
搅拌 ![]() 分液
分液 ![]() 根据
根据![]() 可知,加入
可知,加入![]() ,
,![]() 增大,平衡向左移动
增大,平衡向左移动 ![]()
![]()
【解析】
从废钴钼催化剂(主要含有![]() 、CoS和
、CoS和![]() )经过焙烧后,得到
)经过焙烧后,得到![]() ,CoO和二氧化硫,加入硫酸后,浸取液中的金属离子主要为
,CoO和二氧化硫,加入硫酸后,浸取液中的金属离子主要为![]() 、
、![]() 、
、![]() ,经过萃取和分液得到有机相1和水相1,有机相1中含有
,经过萃取和分液得到有机相1和水相1,有机相1中含有![]() ,加入氨水后得到钼酸铵溶液,经结晶后得到钼酸铵;水相1中含有
,加入氨水后得到钼酸铵溶液,经结晶后得到钼酸铵;水相1中含有![]() 、
、![]() ,SO42-,经萃取分液后,水相2中含有
,SO42-,经萃取分液后,水相2中含有![]() 和
和![]() ,有机相2中含有
,有机相2中含有![]() 、SO42-,加入硫酸后,得到水相3,加入草酸铵,得到草酸钴,加热草酸钴可以得到四氧化三钴,据此分析解答。
、SO42-,加入硫酸后,得到水相3,加入草酸铵,得到草酸钴,加热草酸钴可以得到四氧化三钴,据此分析解答。
(1)![]() 中,铵根离子为+1价,O为-2价,所有元素的化合价之和为0,Mo的化合价为+6,
中,铵根离子为+1价,O为-2价,所有元素的化合价之和为0,Mo的化合价为+6,![]() 和氧气反应的化学方程式为:2
和氧气反应的化学方程式为:2![]() +7O2=2
+7O2=2![]() +4SO2,可知生成物有二氧化硫和
+4SO2,可知生成物有二氧化硫和![]() 两种氧化物;
两种氧化物;
(2)为了加快酸浸速率,可采取的措施为搅拌,可以增大接触面积;
(3)根据图像,找到![]() 最多,
最多,![]() 较少的协萃比为4:1;
较少的协萃比为4:1;
(4)操作1是将有机相和水相分开,是分液;
(5)有机相1中含有![]() ,加入氨水后得到钼酸铵溶液,化学方程式为
,加入氨水后得到钼酸铵溶液,化学方程式为![]() ;
;
(6)根据![]() 可知,加入
可知,加入![]() ,
,![]() 增大,平衡向左移动,能进行反萃取;
增大,平衡向左移动,能进行反萃取;
(7)水相1中含有![]() 、
、![]() ,SO42-,经萃取分液后,水相2中含有
,SO42-,经萃取分液后,水相2中含有![]() 和
和![]() ;
;
(8)![]() 可以表示成
可以表示成![]() ,在碱性条件下可发生氧化反应,生成
,在碱性条件下可发生氧化反应,生成![]() ,电极反应为
,电极反应为![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
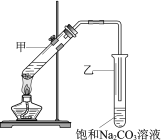
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
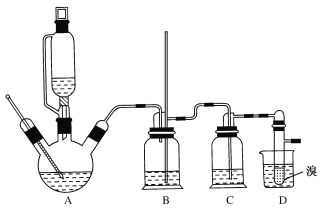
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2mol·L1
C.该反应的化学平衡常数可表示为![]()
D.升高温度,达到平衡状态时 Ⅰ中c(O2)<0.2mol·L1