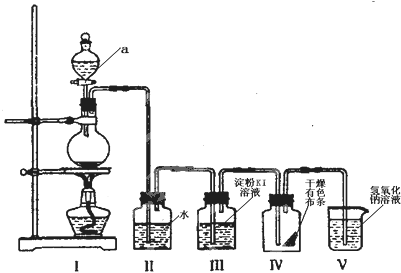
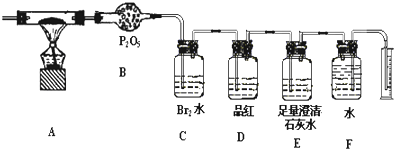
题目内容
18.电化学探究题(1)某研究小组设想用如图1所示的装置利用电化学原理生产硫酸.
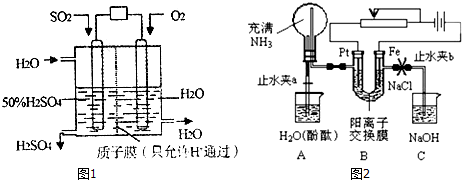
该装置为原电池(填“原电池”或“电解池”),通入O2的电极的电极反应式为O2+4e-+4H+=2H2O,总反应的化学方程式为2SO2+O2+2H2O=2H2SO4.
(2)某课外活动小组设计了如图2所示的装置,调节滑动变阻器,控制电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b).由于粗心,实验并未达到预期目的,(阳离子交换膜只允许阳离子和水的通过).请帮助他们分析并回答下列问题:
ⅰ.装置B中的阴极反应式2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑); 观察到A装置中的三个现象依次是A烧杯中的水倒吸并产生红色喷泉、烧瓶中液面上升到高于左侧尖嘴一定程度后又逐渐下落至与尖嘴相平、最后A烧杯溶液呈红色,导管有气泡溢出.
ⅱ.拔下Fe电极,向该电极所处溶液加入一种黄色的由4种元素组成的化合物的溶液会有某种现象产生以检验该电极反应产生的离子,用离子方程式表示检验反应3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
ⅲ.想达到电解NaCl溶液的目的,可以改进装置或操作,请提出你的意见:把Fe电极换成C、Pt等惰性电极或将装置中两电极换位置等.
分析 (1)如图1装置二氧化硫与氧气发生氧化还原反应,构成闭合回路,形成原电池;氧气为正极,发生还原反应,电池的总反应式为:2SO2+O2+2H2O=2H2SO4;
(2)ⅰ.电解氯化钠时,在电解池的阳极是活泼电极铁本身失去电子发生氧化反应,即阴极上是电解质中的阳离子发生得电子的还原反应;装置A是引发喷泉实验的装置,烧瓶内外存在压强差时就会产生喷泉,根据大气压强原理确定喷泉实验结束时的液面高低变化情况,根据溶液的酸碱性确定溶液颜色的变化情况;
ⅱ.根据亚铁离子遇K3[Fe(CN)6]会出再蓝色沉淀来检验亚铁离子的存在;
ⅲ.在电解饱和食盐水时,要实现电解氯化钠溶液的目的,应该选择惰性电极进行电解.
解答 解:(1)如图1装置二氧化硫与氧气发生氧化还原反应,构成闭合回路,形成原电池;氧气为正极,发生还原反应,电极反应式为:O2+4e-+4H+=2H2O,电池的总反应式为:2SO2+O2+2H2O=2H2SO4,故答案为:原电池;O2+4e-+4H+=2H2O;2SO2+O2+2H2O=2H2SO4;
(2)在电解池的阳极是活泼电极本身失去电子发生氧化反应,Fe-2e-═Fe2+,阴极上是电解质中的阳离子氢离子发生得电子的还原反应,即2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑),在电解池中,因为在阴极铂电极上产生了氢气,所以导致A烧杯中气压增大,氨气和水接触后,因氨气极易溶于水导致水倒吸并产生红色喷泉,当烧瓶中液面上升到高于左侧导管一定程度后又逐渐下落至与导管相平时,烧瓶内外压强相等,喷泉现象结束,由于氨水显碱性,所以最后A烧杯溶液呈红色,并且在导管有气泡氢气溢出,故答案为:2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);A烧杯中的水倒吸并产生红色喷泉;
ⅱ.含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,故答案为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓;
ⅲ.在电解饱和食盐水时,要实现电解氯化钠溶液的目的,应该选择惰性电极进行电解,可以把Fe电极换成C、Pt等惰性电极或将装置中两电极换位置等,
故答案为:把Fe电极换成C、Pt等惰性电极或将装置中两电极换位置等.
点评 本题目是电解池的工作原理和喷泉实验相结合的一道综合知识题目,要求学生具有分析和解决问题的能力,难度较大.

| A. | 盐酸与氢氧化钠的反应可自发进行,因此可用作原电池反应原理 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 铝表面可生成一层致密的氧化物薄膜,因此可用铝容器盛装稀硫酸 |
| A. | 维生素C难溶于水 | |
| B. | 食品中添加维生素C不利于身体健康 | |
| C. | 维生素C具有还原性 | |
| D. | 含维生素C的食物不宜在高温下烹调 |
| A. | c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(SO32-) | B. | c(HSO3-)+c(SO32-)=0.1mol•L-1 | ||
| C. | c(SO32-)<c(H2SO3) | D. | c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-) |
| A. | 加入适量盐酸 | B. | 加入NaOH溶液 | ||
| C. | 置于坩埚中加热 | D. | 配成溶液后通入CO2 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |