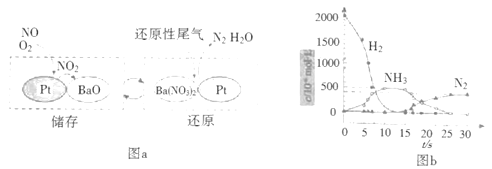
题目内容
【题目】二氧化硫直接排放会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
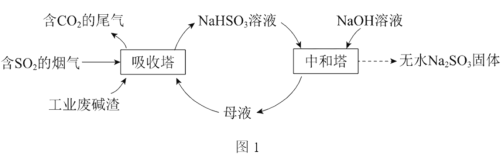
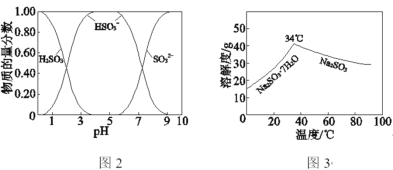
已知:H2SO3、HSO3、SO32在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____________________。
(2)吸收烟气
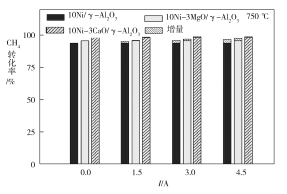
①为提高NaHSO3的产率,应控制吸收塔中的pH为________。
②已知下列反应:
SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1=164.3kJ·mol1
CO2(g)+2OH(aq)==CO32(aq)+H2O(l)ΔH2=109.4kJ·mol1
2HSO3(aq)==SO32(aq)+SO2(g)+H2O(l)ΔH3=+34.0kJ·mol1
吸收塔中Na2CO3溶液吸收SO2生成HSO3的热化学方程式是________。
③吸收塔中的温度不宜过高,可能的原因是________(写出1种即可)。
(3)制备无水Na2SO3
①中和塔中反应的离子方程式为_________________________________。
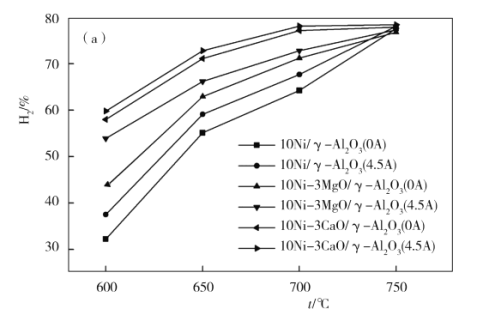
②从中和塔得到的Na2SO3溶液中要获得无水Na2SO3固体,需控制温度____________,同时还要_______________,以防止Na2SO3氧化。
【答案】CO32+H2O![]() OH+HCO3 4~5 2SO2(g)+CO32(aq)+H2O(l)==2HSO3(aq)+CO2(g)ΔH=88.9kJ·mol1 防止SO2的溶解度下降;防止HSO3受热分解;防止HSO3的氧化速率加快等 HSO3+OH==H2O+SO32 高于34℃ 隔绝空气
OH+HCO3 4~5 2SO2(g)+CO32(aq)+H2O(l)==2HSO3(aq)+CO2(g)ΔH=88.9kJ·mol1 防止SO2的溶解度下降;防止HSO3受热分解;防止HSO3的氧化速率加快等 HSO3+OH==H2O+SO32 高于34℃ 隔绝空气
【解析】
(1)Na2CO3为强碱弱酸盐,碳酸根水解呈碱性,离子方程式为CO32-+H2OOH-+HCO3-;
(2)①由图象可知pH在4~5时NaHSO3的物质的量分数最高;
②已知:i:SO2(g)+2OH- (aq)=SO32- (aq)+H2O(l)△H1=-164.3kJmol-1
ii:CO2(g)+2OH- (aq)=CO32- (aq)+H2O(l)△H2=-109.4kJmol-1
Iii:2HSO3- (aq)=SO32- (aq)+SO2(g)+H2O(l)△H3=+34.0kJmol-1,
利用盖斯定律将i-ii-iii可得Na2CO3溶液吸收SO2生成HSO3-的热化学方程式为2SO2(g)+CO32-(aq)+H2O(l)=2HSO3-(aq)+CO2(g)△H=-88.9kJmol-1,
③HSO3-不稳定,受热易分解;如温度过高,可导致气体的溶解度下降;且HSO3-易被氧化,所以吸收塔的温度不易过高;
(3)①中和塔中亚硫酸氢钠和氢氧化钠反应生成亚硫酸钠和水,离子方程式为:HSO3+OH==H2O+SO32;
②据图可知温度高于34℃时亚硫酸钠的溶解度随温度升高开始下降,所以需控制温度高于34℃,便于析出无水亚硫酸钠;同时要隔绝空气,以防止Na2SO3氧化。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案