题目内容
【题目】工业上利用软锰矿浆(软锰矿的主要成分是MnO2,还含有硅、铁、铝、钙、镁和少量重金属镍的化合物等杂质)为原料制取电解锰和四氧化三锰。

注:过量的软锰矿将Fe2+氧化为Fe3+。
(1)纤维素[(C6H10O5)n]还原MnO2时,发生反应的化学方程式为_______。
(2)已知:Kp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,加入NH3·H2O后,Al3+浓度为l×10-6mol/L时,溶液中Fe3+浓度为_________
(3)pH对除镍效果的影响如图1:

控制pH为4.5~5.0除镍效果最好,原因是__________
(4)电解MnSO4溶液制备电解锰,用惰性电极电解,阳极的电极反应式为________,为保证电解的顺利进行,电解液必须保持一定的Mn2+浓度。Mn2+浓度和电流效率的关系如图2所示。由图可知当Mn2+浓度大于22g/L时,电流效率随Mn2+浓度增大反而下降,其原因是________。

(5)MnSO4溶液制备四氧化三锰。氨水作沉淀剂,沉淀被空气氧化所得产品的X射线图见图3。
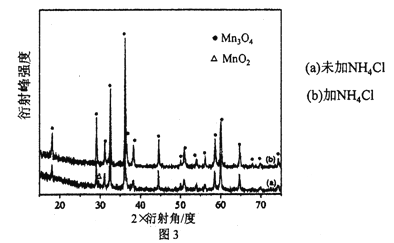
Mn2+形成Mn(OH)2时产生少量Mn2(OH)2SO4,加入NH4Cl会影响Mn2(OH)2SO4的氧化产物,写出NH4Cl存在时,Mn2(OH)2SO4被O2氧化发生反应的离子方程式___________。
【答案】 12nMnO2+(C6H10O5)n+12nH2SO4=12nMnSO4+6nCO2+17nH2O 3×10-12mol/L pH过低,会与硫化钡产生硫化氢气体;pH过高,Mn2+被沉淀 2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O Mn2+浓度增大,容易产生Mn(OH)2沉淀 3Mn2(OH)2SO4+O2=2Mn3O4+6H++3SO42-
【解析】(1)纤维素[(C6H10O5)n]具有还原性,MnO2具有氧化性,二者可发生氧化还原反应,发生反应的化学方程式为:12nMnO2+(C6H10O5)n+12nH2SO4=12nMnSO4+6nCO2+17nH2O,答案为:12nMnO2+(C6H10O5)n+12nH2SO4=12nMnSO4+6nCO2+17nH2O
(2)Kp[Al(OH)3]=c(Al3+)×c3(OH-)=1×10-33,所以c3(OH-)=1×10-27;,Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)=3×10-39,所以c(Fe3+)=![]() =3
=3![]() mol/L,答案为:3×10-12mol/L
mol/L,答案为:3×10-12mol/L
(3)pH过低,会与硫化钡反应产生硫化氢气体,pH过高,Mn2+被沉淀,并且根据表中的数据知道,当pH小于4.2的时候,镍离子随pH的减小而残留率增加,当pH大于5的时候,镍离子随pH的增大而残留率增加,所以控制pH为4.5![]() 5.0镍离子的含量最小,除镍效果最好;答案为:pH过低,会与硫化钡产生硫化氢气体,pH过高,Mn2+被沉淀
5.0镍离子的含量最小,除镍效果最好;答案为:pH过低,会与硫化钡产生硫化氢气体,pH过高,Mn2+被沉淀
(4)“电解”时用惰性电极电解,阳极发生氧化反应,应该是水电离出的氢氧根离子放电,电极反应式为:2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O;当Mn2+浓度大于22g/L时,容易产生Mn(OH)2沉淀,电流效率反而下降;答案为:2H2O-4e-=O2↑+4H+或4OH--4e-=O2↑+2H2O,Mn2+浓度增大,容易产生Mn(OH)2沉淀
(5)由X射线图可知,未加NH4Cl时Mn2(OH)2SO4的氧化产物主要是MnO2,加NH4Cl时Mn2(OH)2SO4的氧化产物主要是Mn3O4,因此NH4Cl存在时,Mn2(OH)2SO4被O2氧化发生反应的离子方程式为:3Mn2(OH)2SO4+O2=2Mn3O4+6H++3SO42-;答案为:3Mn2(OH)2SO4+O2=2Mn3O4+6H++3SO42-