题目内容
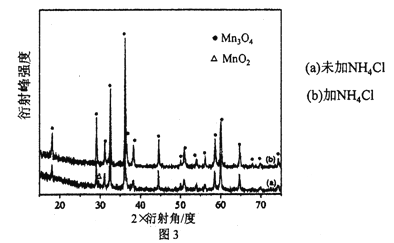
【题目】现有三个体积相同的密闭容器,按下图所示投料,并在T℃条件下开始反应,其中容器I保持恒压100kPa。已知:分压=总压×物质的量分数,对于2NO2(g)![]() N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是
N2O4(g)ΔH<0,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75, 式中p(N2O4) 、p(NO2)为气体分压。下列说法正确的是

A. 达平衡时,容器Ⅱ中N2O4转化率小于50%
B. 达平衡时,容器Ⅰ中N2O4分压比容器Ⅲ中的大
C. 达平衡时,容器Ⅰ中N2O4的体积分数比容器Ⅱ中的大
D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,达到平衡前v(正)<v(逆)
【答案】AD
【解析】若在恒温恒容条件下,三个容器中的反应为等效平衡。A.将容器Ⅰ中2molNO2转化为N2O4,可得1molN2O4,设有xmolN2O4反应生成NO2,根据已知条件容器I中保持恒压100kPa,T℃时,标准平衡常数KΘ={p(N2O4)/100kPa}/{[p(NO2)] /100kPa}2=0.75,可知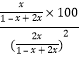 =0.75,解得x=0.5,因此N2O4转化率=
=0.75,解得x=0.5,因此N2O4转化率=![]() =50%,达到平衡时由于容器Ⅰ是绝热恒容,容器Ⅱ是恒温恒容,所以达到平衡时容器Ⅰ中的温度高于容器Ⅱ中的温度,而该反应是放热反应,因此平衡时容器Ⅱ中N2O4转化率小于50%,A正确;B. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅲ中的温度,容器Ⅰ中N2O4的物质的量小于容器Ⅲ,因此容器Ⅰ中N2O4分压比容器Ⅲ中的小,B错误;C. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅱ中的温度,导致容器Ⅰ中N2O4的物质的量小于容器Ⅱ,因此容器Ⅰ中N2O4的体积分数比容器Ⅱ中的小,C错误;D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,由于容器Ⅲ保持恒温恒压,则必须扩大容器的体积,而该反应是气体体积减小的反应,所以在达到平衡前该反应一直向逆反应方向进行,因此达到平衡前v(正)<v(逆),D正确;答案选AD.
=50%,达到平衡时由于容器Ⅰ是绝热恒容,容器Ⅱ是恒温恒容,所以达到平衡时容器Ⅰ中的温度高于容器Ⅱ中的温度,而该反应是放热反应,因此平衡时容器Ⅱ中N2O4转化率小于50%,A正确;B. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅲ中的温度,容器Ⅰ中N2O4的物质的量小于容器Ⅲ,因此容器Ⅰ中N2O4分压比容器Ⅲ中的小,B错误;C. 容器Ⅰ是绝热恒容,达平衡时,容器Ⅰ中的温度高于容器Ⅱ中的温度,导致容器Ⅰ中N2O4的物质的量小于容器Ⅱ,因此容器Ⅰ中N2O4的体积分数比容器Ⅱ中的小,C错误;D. 若起始时向容器Ⅲ中充入2molN2O4、2molNO2,由于容器Ⅲ保持恒温恒压,则必须扩大容器的体积,而该反应是气体体积减小的反应,所以在达到平衡前该反应一直向逆反应方向进行,因此达到平衡前v(正)<v(逆),D正确;答案选AD.

 名校课堂系列答案
名校课堂系列答案