题目内容
【题目】黄铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用黄铁矿烧渣为原料制备高档颜料—铁红(Fe2O3)的流程如下:

回答下列问题:
(1)“焙烧”时所添加的最佳还原剂是________(填序号)。
a.焦炭 b.硫黄 c.镁粉 d.锌粉
(2)“过滤1”后的滤液中溶质的主要成分是________________(填化学式)。
(3)“沉淀反应”时反应温度不宜过高,其原因为________(用化学方程式表示)。
(4)为检验FeCO3是否洗涤干净,可以向最后一次洗涤液中滴加________溶液。
(5)在空气中煅烧FeCO3生成铁红和另一种氧化物,反应的化学方程式为________。
(6)现有黄铁矿烧渣500t,铁元素的质量分数为16.8%,经过一系列转化后,得到90t铁红,该产品的产率为________。(提示:![]() )
)
【答案】b ![]()
![]() 稀盐酸和
稀盐酸和![]()
![]() 37.5%
37.5%
【解析】
本题要从含有杂质的黄铁矿烧渣中得到铁红(![]() ),第一步焙烧将所有氧化物还原为单质铁和单质硅,接下来用硫酸酸浸将铁转变为
),第一步焙烧将所有氧化物还原为单质铁和单质硅,接下来用硫酸酸浸将铁转变为![]() ,硅不与硫酸反应,可以过滤除去;接下来加入碳酸氢铵,得到
,硅不与硫酸反应,可以过滤除去;接下来加入碳酸氢铵,得到![]() 沉淀,过滤、洗涤、干燥后再煅烧,煅烧时
沉淀,过滤、洗涤、干燥后再煅烧,煅烧时![]() 被空气中的氧气氧化,最终得到
被空气中的氧气氧化,最终得到![]() ,据此来分析即可。
,据此来分析即可。
(1)焙烧时加入焦炭是最好的选择,焦炭可以还原铁的氧化物和硅的氧化物,过量的焦炭在酸浸时不溶于硫酸,过滤即可除去,答案选a;
(2)根据分析,过滤1后的溶液主要是![]() 溶液;
溶液;
(3)![]() 极易被空气中的氧气氧化,若温度太高则溶液中的
极易被空气中的氧气氧化,若温度太高则溶液中的![]() 将被氧化为
将被氧化为![]() :
:![]() ;
;
(4)若要检验是否洗涤干净,只要检验沉淀中是否含有![]() 即可,因此我们可以取最后一次洗涤液,加入稀盐酸和
即可,因此我们可以取最后一次洗涤液,加入稀盐酸和![]() 溶液,若无白色沉淀产生则证明已经洗涤干净;
溶液,若无白色沉淀产生则证明已经洗涤干净;
(5)空气中有氧气,氧气可将![]() 氧化成
氧化成![]() ,另一种氧化物应该是碳元素形成的,即二氧化碳:
,另一种氧化物应该是碳元素形成的,即二氧化碳:![]() ;
;
(6)首先根据![]() 算出铁元素的质量,铁的质量与氧化铁的摩尔质量比为
算出铁元素的质量,铁的质量与氧化铁的摩尔质量比为![]() ,因此理论上能产生240t的铁红,产率为
,因此理论上能产生240t的铁红,产率为![]() 。
。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】废旧印刷电路板中铜元素含量较高,为充分利用资源,变废为宝实验小组探究利用废旧印刷电路板来制备胆矾,具体流程如图所示:
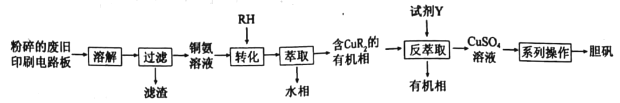
请回答:
(1)“溶解”过程中,为选择合适的溶解试剂,查阅资料后,小组同学设计如下实验。
实验编号 | 铜片质量/g | 试剂及用量 | 现象 |
1号 | 0.5 | 30%H2O250mL、蒸馏水8mL | 10h后,溶液变为浅蓝色,铜片表面附着蓝色沉淀 |
2号 | 0.5 | 30%H2O250mL、5mol·L-1H2SO48mL | 开始铜片表面有气泡生成(先慢后快,40min后,溶液蓝色明显铜片表面光亮 |
3号 | 0.5 | 30%H2O250mL、5mol·L-1氨水8mL | 立即产生大量气泡溶液为深蓝色,铜片表面附着少量蓝色沉淀 |
注:深蓝色溶液为铜氨溶液。
①1号实验中发生反应的化学方程式为______________。
②实验室检验2号实验中产生气体的操作和现象为______________。
③与2号实验相比,3号实验的优点是生成了铜氨配合物,加快了反应速率;其不足之处为______________。
④为弥补3号实验的不足,该小组继续进行改进,设计了4号实验(见下表,并得到了预期的实验现象。
实验编号 | 铜片质量/g | 试剂及用量 | 现象 |
4号 | 0.5 | 30%H2O250mL5mol·L-1氨水8mL和适量试剂X | 立即产生大量气泡,溶液为深蓝色,铜片表面仍光亮 |
则4号实验中,试剂x应为______________。
(2)“转化”时铜氨溶液中的Cu(NH3)42+与有机物RH发生反应的离子方程式为______________。“反萃取”过程中,所加试剂Y的化学式为______________。
(3)“系列操作”具体指_____________(填选项字母)。
A.蒸发浓缩、趁热过滤、洗涤、干燥
B.蒸发浓缩至溶液表面出现晶膜后停止加热,冷却、过滤、洗涤、干燥
C.蒸发浓缩至大量晶体析出后停止加热,冷却、过滤、洗涤、干燥
(4)为测定铜氨溶液中铜元素的含量,可采用如下方法:
i.移取500mL铜氨溶液于锥形瓶中,滴加稀H2SO4,调节溶液的pH为3-4
ⅱ.加入适当过量的KI溶液,并加入3mL0.5%淀粉溶液(![]() );
);
ⅲ.用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准液体积为5.80mL(I2+2S2O32-=2I-+S4O262-)。
①iii中滴定至终点时,溶液的颜色变化为______________。
②该铜氨溶液中铜元素的含量为______________g·mL-1(保留两位有效数字)。