题目内容
【题目】为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是
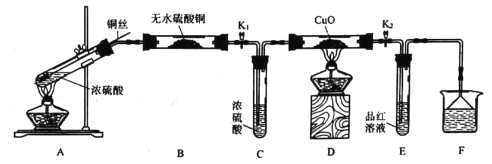
A.F中可以盛放酸性KMnO4溶液
B.为确认有硫酸铜生成,可向反应后的A中加水
C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断
D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素
【答案】B
【解析】
此探究实验的实验目的为研究铜与浓硫酸的反应,A中发生的反应为![]() ,B的作用是为了验证水蒸气的生成,C中浓硫酸的作用是除掉混合气体中的水,防止后续热还原操作出现危险,D装置是为了探究是否有
,B的作用是为了验证水蒸气的生成,C中浓硫酸的作用是除掉混合气体中的水,防止后续热还原操作出现危险,D装置是为了探究是否有![]() 等还原性气体的生成,E中品红褪色,说明产物中有
等还原性气体的生成,E中品红褪色,说明产物中有![]() ,F装置为尾气处理装置。
,F装置为尾气处理装置。
A. 根据上述分析,F为尾气处理装置,可以使用具有强氧化性的KMnO4溶液来吸收尾气![]() ,A正确;
,A正确;
B. 由于反应结束后A装置中还残留有浓![]() ,故应当取少量A中的溶液,加入水中,进而观察现象,B错误;
,故应当取少量A中的溶液,加入水中,进而观察现象,B错误;
C. A装置中水的来源可能有两部分,一是反应生成的,二是浓![]() 中本来就有的,故此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断,C正确;
中本来就有的,故此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断,C正确;
D. 可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素,D正确;
故答案选B。

【题目】下表为短周期元素,表中所列序号分别代表一种元素。(除说明外都用化学用语填空)
① | ② | |||||||
③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
(1)上述元素中金属性最强和非金属性最强的元素名称分别是______,_______;
(2)①和②的气态氢化物稳定性比较(写化学式):______________;
(3)在上述元素中其最高价氧化物对应水化物酸性最强的酸为_________;写出⑤单质与③的最高价氧化物对应水化物反应的化学方程式为____________ 。描述H2在⑧单质中燃烧的现象___________________;
(4)现有上表中某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,该元素在周期表中的位置是_________________;
(5)比较②和③对应简单离子的离子半径大小(用相应离子符号表示)________;
(6)写出③的最高价氧化物对应水化物的电子式___________;其含有的化学键类型是____________。
【题目】消除尾气中的NO是环境科学研究的热点课题。
I.NO氧化机理
已知:2NO(g)+O2(g) ![]() 2NO2(g)△H=-110kJ·mol-1
2NO2(g)△H=-110kJ·mol-1
25℃时,将NO和O2按物质的量之比为2:1充入恒容反应容器中,用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 |
|
p/kPa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;随着反应进行,反应速率逐渐减小的原因是______________。
用平衡分压代替平衡浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为_______(保留3位有效数字)。
(2)查阅资料,对于总反应2NOg)+O2(g) ![]() 2NO2(g)有如下两步历程
2NO2(g)有如下两步历程
第一步2NO(g) ![]() N2O2(g) 快速反应
N2O2(g) 快速反应
第二步N2O2(g)+O2(g) ![]() 2NO2(g) 慢反应
2NO2(g) 慢反应
总反应速率主要由第_____步决定;若利用分子捕获器适当减少反应容器中的N2O2,总反应的平衡常数K(p)将___(填“增大”、“减小”或“不变”);若提高反应温度至35℃,则体系压强P(35℃)______P(25℃)(填“大于”、“等于”或“小于”)。
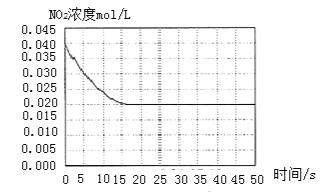
II. 某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。
(1)反应体系达平衡后压强为P1,若升高温度,再次达平衡后,混合气体的平均相对分子质量______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() ;
;
(2)若在恒温恒容条件下,向平衡体系中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol/L,则P2:P1=______
(3)该温度下反应2NO(g)+O2(g) ![]() 2NO2(g)的化学平衡常数K为______。
2NO2(g)的化学平衡常数K为______。